题目内容
某学校研究性学习小组,以某工厂生产过程中产生的废弃物“红色铁泥”为研究对象,探究红色物质的成分,请你参与他们的活动.
【小组讨论】同学们对“铁泥”中所含红色物质作了如下猜想:
甲同学:红色物质是铜 乙同学:红色物质是氧化铁
丙同学:红色物质是氢氧化铁 丁同学:红色物质是氧化铁和氢氧化铁
【资料在线】①该厂“红色铁泥”主要是生产过程中使用铁触媒(一种催化剂)后的废弃物,除红色物质外,还含有通常不与酸、碱、氧气反应及受热不发生分解的物质; ②氢氧化铁受热时,会分解产生氧化铁和水.
【实验验证】为验证上述四位同学的猜想,小明、小红两位同学进行了如下实验:小明取一定量“红色铁泥”样品,加入稀硫酸,观察到有黄色溶液产生,于是得出“乙同学的猜想成立”的结论;
小红同学按下列顺序进行实验:先取适量已晒干的“红色铁泥”,称量其质量为m1g; 再将“红色铁泥”置于坩埚中充分加热并在干燥器中冷却后,称量其质量为m2g.
【问题讨论】请回答下列问题:
(1)其他同学一致认为,小明同学得出的“乙同学的猜想成立”的结论不合理,理由是______;
(2)针对小红同学的实验操作及测定的两个数据,进行分析:
①若甲同学的猜想成立,则实验中反应的化学方程式为______;
②若m1=m2,则______(填“甲”、“乙”或“丙”)同学的猜想成立;
【拓展应用】
应用之一:若“红色铁泥”中“红色物质是氢氧化铁”,可应用下列实验方案回收“红色铁泥”中的铁元素制得“铁红”(化学式为Fe2O3,是红色油漆的重要原料):
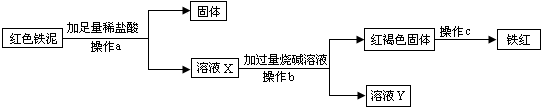
(1)上述过程中发生了三个反应,写出其中的一个化学方程式:______;
(2)a、b是同一实验操作,该操作需要的玻璃仪器有:烧杯、玻璃棒和______;
(3)若通过上述途径获得的“铁红”的纯度(Fe2O3的质量分数)不高,试分析可能的原因____________(说出一点即可).
应用之二:为了测定用以上方法制得的“铁红”的纯度,同学们又进行了下列实验探究.请你参与过程分析与交流.
查阅资料:草酸(乙二酸H2C2O4)在浓H2SO4存在下发生下列反应:H2C2O4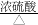 CO↑+CO2↑+H2O
CO↑+CO2↑+H2O
实验准备:按右图安装好实验装置:
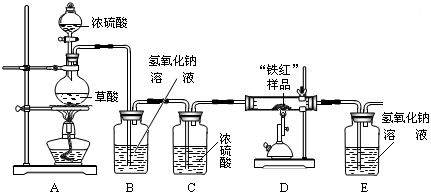
实验数据:取10g“铁红”样品进行实验,所得实验数据有右表所示甲、乙两组:
| 甲组数据 | 乙组数据 | ||
| 玻璃管连同样品的质量 | E装置连同药品的质量 | ||
| 实验前 | 试验后 | 实验前 | 试验后 |
| 60g | 57.6g | 100g | 107g |
(1)同学们拟用纯净的CO还原“铁红”,所设计的实验装置中B、C盛放的试剂的作用依次是______、______;
(2)从环保角度看,请你提出改进该实验装置的建议______;
(3)从实验安全和实验操作程序看,首先要检查装置的气密性,实验开始先加热______(填“A”或“D”)处,实验结束时,应______(填“先”或“后”)停止D处的加热;
(4)同学们认为,若用乙组数据进行计算“铁红”的纯度,则实验测定结果却偏大,分析造成偏大的原因可能是______;
(5)请依据甲组数据,计算该“铁红”样品的纯度.(写出计算的过程)
解:[问题讨论](1)因为氢氧化铁和氧化铁都能和硫酸反应,形成黄色的硫酸铁溶液;
(2)铜能与氧气加热反应,而氧化铁不反应,化学方程式:2Cu+O2 2CuO;加热质量不变,说明没有铜,故乙同学的猜想正确;
2CuO;加热质量不变,说明没有铜,故乙同学的猜想正确;
应用之一:(1)氢氧化铁和盐酸反应的化学方程式:Fe(OH)3+3HCl=FeCl3+3H2O
(2)因为固体和液体分离要用过滤操作,故答案为:漏斗
(3)纯度不高,说明铁没有完全转化到最终产物,可能是氧化铁加热不充分,或操作a得到的溶液X不澄清等;
应用之二:(1)A中反应产物有二氧化碳、一氧化碳、水,要净化、除杂,故装置的作用是除去一氧化碳中含有的二氧化碳、干燥一氧化碳
(2)CO有毒,过量气体不能排放在空气中,应在装置E后增添尾气处理装置(在装置E后或放一盏燃着的酒精灯;或在装置E后连接排水法收集气体的装置;或在装置E后套上气球或气囊)
(3)CO不纯,点燃可能会引起爆炸,还原结束要防止铁被氧化,所以要先产生一氧化碳,反应后还要继续通入一氧化碳至装置冷却;
(4)空气中的二氧化碳也一起被E中溶液吸收,所以会造成结果偏大;
(5)可依据化学方程式,利用量差法进行计算.写出方程并列出相应的已、未知量,得出答案.设样品中氧化铁的故答案为:
【问题讨论】(1)氢氧化铁也能和硫酸反应,形成黄色溶液(2)2Cu+O2 2CuO 乙
2CuO 乙
之一:(1)Fe(OH)3+3HCl=FeCl3+3H2O(2)漏斗(3)红褐色固体加热不充分(或操作a得到的溶液X不澄清等.只要合理即可)
应用之二:(1)除去一氧化碳中含有的二氧化碳、干燥一氧化碳(2)在装置E后增添尾
气处理装置(在装置E后或放一盏燃着的酒精灯;或在装置E后连接排水法收集气体的装置;或
在装置E后套上气球或气囊)(3)A、先(4)装置E中的氢氧化钠溶液吸收了空气中的
二氧化碳(每空均1分)
(5)质量为X,由表中甲组数据
Fe2O3~3O
160 48
X (60-57.6)g
160:48=X:(60-57.6)g
解得:X=8g
纯度为: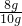 ×100%=80%
×100%=80%
答:其纯度为80%
分析:[问题讨论](1)溶液中Fe3+呈黄色,氧化铁和氢氧化铁都能和硫酸反应,生成Fe3+;
(2)若为铜,则是铜在加热时与空气中的氧气反应;加热质量不变,说明是氧化铁;
应用之一:(1)主要有三个反应,氢氧化铁和盐酸反应、三氯化铁和氢氧化钠反应、氢氧化铁的加热分解;
(2)固体和溶液分离,要采用过滤操作;
(3)若纯度不高,由元素守恒,可能有损失的铁,则原因可能为红褐色固体加热不充分或操作a得到的溶液X不澄清等;
应用之二:(1)A中反应产物有二氧化碳、一氧化碳、水,在D中要CO还原氧化铁,并进行成分计算,所以要排除A中产生的二氧化碳和水;
(2)为确保氧化铁被完全反应,CO过量,有毒不能排放在空气中,要增添尾气处理装置;
(3)CO不纯,点燃可能会引起爆炸,应让CO充满整个装置,所以要先让A中反应发生,结束时为防止铁被氧化,要继续通一会CO,所以要先停止D加热;
(4)装置与外界空气相通,氢氧化钠溶液易吸收空气中CO2;
(5)样品中氧化铁的质量可由表中甲组数据计算;铁红的纯度用氧化铁质量和样品质量来求.
点评:此题综合性很强,要根据物质的性质和题目要求,结合相应的实验操作进行解答,亚铁离子在溶液中是浅绿色的,铁离子在溶液中呈现黄色.
(2)铜能与氧气加热反应,而氧化铁不反应,化学方程式:2Cu+O2
 2CuO;加热质量不变,说明没有铜,故乙同学的猜想正确;
2CuO;加热质量不变,说明没有铜,故乙同学的猜想正确;应用之一:(1)氢氧化铁和盐酸反应的化学方程式:Fe(OH)3+3HCl=FeCl3+3H2O
(2)因为固体和液体分离要用过滤操作,故答案为:漏斗
(3)纯度不高,说明铁没有完全转化到最终产物,可能是氧化铁加热不充分,或操作a得到的溶液X不澄清等;
应用之二:(1)A中反应产物有二氧化碳、一氧化碳、水,要净化、除杂,故装置的作用是除去一氧化碳中含有的二氧化碳、干燥一氧化碳
(2)CO有毒,过量气体不能排放在空气中,应在装置E后增添尾气处理装置(在装置E后或放一盏燃着的酒精灯;或在装置E后连接排水法收集气体的装置;或在装置E后套上气球或气囊)
(3)CO不纯,点燃可能会引起爆炸,还原结束要防止铁被氧化,所以要先产生一氧化碳,反应后还要继续通入一氧化碳至装置冷却;
(4)空气中的二氧化碳也一起被E中溶液吸收,所以会造成结果偏大;
(5)可依据化学方程式,利用量差法进行计算.写出方程并列出相应的已、未知量,得出答案.设样品中氧化铁的故答案为:
【问题讨论】(1)氢氧化铁也能和硫酸反应,形成黄色溶液(2)2Cu+O2
 2CuO 乙
2CuO 乙之一:(1)Fe(OH)3+3HCl=FeCl3+3H2O(2)漏斗(3)红褐色固体加热不充分(或操作a得到的溶液X不澄清等.只要合理即可)
应用之二:(1)除去一氧化碳中含有的二氧化碳、干燥一氧化碳(2)在装置E后增添尾
气处理装置(在装置E后或放一盏燃着的酒精灯;或在装置E后连接排水法收集气体的装置;或
在装置E后套上气球或气囊)(3)A、先(4)装置E中的氢氧化钠溶液吸收了空气中的
二氧化碳(每空均1分)
(5)质量为X,由表中甲组数据
Fe2O3~3O
160 48
X (60-57.6)g
160:48=X:(60-57.6)g
解得:X=8g
纯度为:
 ×100%=80%
×100%=80%答:其纯度为80%
分析:[问题讨论](1)溶液中Fe3+呈黄色,氧化铁和氢氧化铁都能和硫酸反应,生成Fe3+;
(2)若为铜,则是铜在加热时与空气中的氧气反应;加热质量不变,说明是氧化铁;
应用之一:(1)主要有三个反应,氢氧化铁和盐酸反应、三氯化铁和氢氧化钠反应、氢氧化铁的加热分解;
(2)固体和溶液分离,要采用过滤操作;
(3)若纯度不高,由元素守恒,可能有损失的铁,则原因可能为红褐色固体加热不充分或操作a得到的溶液X不澄清等;
应用之二:(1)A中反应产物有二氧化碳、一氧化碳、水,在D中要CO还原氧化铁,并进行成分计算,所以要排除A中产生的二氧化碳和水;
(2)为确保氧化铁被完全反应,CO过量,有毒不能排放在空气中,要增添尾气处理装置;
(3)CO不纯,点燃可能会引起爆炸,应让CO充满整个装置,所以要先让A中反应发生,结束时为防止铁被氧化,要继续通一会CO,所以要先停止D加热;
(4)装置与外界空气相通,氢氧化钠溶液易吸收空气中CO2;
(5)样品中氧化铁的质量可由表中甲组数据计算;铁红的纯度用氧化铁质量和样品质量来求.
点评:此题综合性很强,要根据物质的性质和题目要求,结合相应的实验操作进行解答,亚铁离子在溶液中是浅绿色的,铁离子在溶液中呈现黄色.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
石灰石是我市的主要矿产之一.某学校研究性学习小组为了测定当地矿山中碳酸钙的质量分数,取来了一些矿石样品,并取稀盐酸200g,平均分成4份,进行实验,结果如下:(杂质既不溶于水,也不和酸发生反应)
(1)上表中m的数值是 .
(2)试计算这种石灰石中碳酸钙的质量分数.(结果精确到0.1%)
| 实验 | 1 | 2 | 3 | 4 |
| 加入样品的质量/g | 15 | 22.5 | 30 | 37.5 |
| 生成的CO2质量/g | 4.4 | 6.6 | 8.0 | m |
(2)试计算这种石灰石中碳酸钙的质量分数.(结果精确到0.1%)
化学老师交给某学校研究性学习小组一个任务:测定实验室里一瓶久置的NaOH固体是否变质.该小组的同学进行了如下实验探究:
提出问题:猜想I:没变质,全部是NaOH;
猜想II:部分变质, ;
猜想Ⅲ:完全变质,全部是Na2CO3.
查阅资料:部分溶液在常温下的pH如下:
设计方案并进行实验:请你与他们一起共同完成,并回答所给问题.
上述步骤①中,称量氢氧化钠固体样品用到的玻璃仪器名称是 ,滴加过量BaCl2溶液的目的是
实验结论:通过实验,说明上述猜想中 是正确的.
拓展:该小组同学为测定出该NaOH固体的变质程度,继续将上述白色沉淀过滤、洗净、干燥,称得其质量为4.0g,则原样品中NaOH的质量分数为 (保留一位小数).
反思:久置的氢氧化钠变质的原因是 (用化学方程式表示).
提出问题:猜想I:没变质,全部是NaOH;
猜想II:部分变质,
猜想Ⅲ:完全变质,全部是Na2CO3.
查阅资料:部分溶液在常温下的pH如下:
| 盐溶液 | NaCl | Na2CO3 | BaCl2 |
| pH | 等于7 | 大于7 | 等于7 |
| 实验步骤 | 实验现象 | 实验结论 |
| ①称取上述氢氧化钠固体样品10.0g溶于100ml,水配成溶液,向溶液中滴加氯化钡溶液至过量,充分反应后,静置. | 产生白色沉淀 | 说明久置固体中,一定含有 |
| ②用玻璃棒蘸取少量①中充分反应后的上层清液滴在一小块pH试纸上,与标准比色卡对比,测出pH. | pH=11 | 说明久置固体中,还一定含有 |
实验结论:通过实验,说明上述猜想中
拓展:该小组同学为测定出该NaOH固体的变质程度,继续将上述白色沉淀过滤、洗净、干燥,称得其质量为4.0g,则原样品中NaOH的质量分数为
反思:久置的氢氧化钠变质的原因是
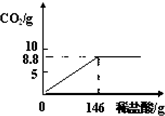 石灰石是我市的主要矿产之一.为了测定当地石灰石中碳酸钙的质量分数,某学校研究性学习小组进行了如下实验:取石灰石样品25g,向其中滴加稀盐酸,测定生成气体CO2的质量.加入稀盐酸的质量与产生CO2气体的质量关系如图所示.试计算(杂质不与酸反应,高温也不分解):
石灰石是我市的主要矿产之一.为了测定当地石灰石中碳酸钙的质量分数,某学校研究性学习小组进行了如下实验:取石灰石样品25g,向其中滴加稀盐酸,测定生成气体CO2的质量.加入稀盐酸的质量与产生CO2气体的质量关系如图所示.试计算(杂质不与酸反应,高温也不分解):