题目内容
有一包粉末,可能由KCl、K2SO4、K2CO3、CuCl2、MgCl2中的一种或几种物质组成.现在做如下实验:
(1)根据以下实验操作及现象,请回答:
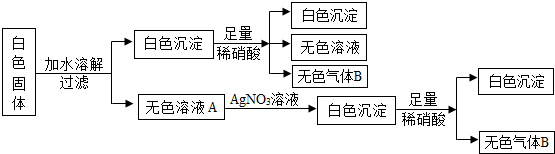
实验1:取少量粉末,加水溶解,得到无色透明溶液.
实验2:取1所得溶液少许,加入NaOH溶液,看不到明显现象.
实验3:取1所得溶液少许,加入适量硝酸钡溶液,出现白色沉淀.
实验4:将实验3所得混合物过滤后,在沉淀中加入足量稀硝酸,沉淀部分溶解并有气泡生成.原粉末中一定没有
(2)据上述实验现象,可推知原粉末中可能有
(1)根据以下实验操作及现象,请回答:
实验1:取少量粉末,加水溶解,得到无色透明溶液.
实验2:取1所得溶液少许,加入NaOH溶液,看不到明显现象.
实验3:取1所得溶液少许,加入适量硝酸钡溶液,出现白色沉淀.
实验4:将实验3所得混合物过滤后,在沉淀中加入足量稀硝酸,沉淀部分溶解并有气泡生成.原粉末中一定没有
CuCl2、MgCl2
CuCl2、MgCl2
,原粉末中一定有K2SO4、K2CO3
K2SO4、K2CO3
.(2)据上述实验现象,可推知原粉末中可能有
KCl
KCl
,为了进一步验证原粉末中可能含有的成分是否存在,请你设计实验证明:| 操作步骤 | 现 象 | 结 论 |
| 该物质不存在 |
分析:根据已有的知识进行分析,氯化铜溶液为蓝色;氢氧化钠能与氯化镁反应生成氢氧化镁白色沉淀;硫酸钾能与硝酸化钡反应生成硫酸钡沉淀,硫酸钡不溶于稀硝酸,碳酸钾能与硝酸化钡反应生成碳酸钡沉淀,碳酸钡能溶于稀硝酸;检验氯化钾的存在就是检验氯离子,氯化钾能与硝酸银反应生成白色氯化银沉淀,据此解答.
解答:解:(1)实验1:加水溶解溶液是无色的,说明不含有氯化铜;
实验2:取1所得溶液少许,加入氢氧化钠溶液,没有明显的现象,说明不含有氯化镁,因为氯化镁能与氢氧化钠反应生成氢氧化镁白色沉淀;
实验3:取1所得溶液少许,加入适量硝酸钡溶液,得到了白色沉淀,硫酸钾能与硝酸化钡反应生成硫酸钡沉淀,碳酸钾能与硝酸化钡反应生成碳酸钡沉淀,故白色粉末中一定含有硫酸钾或碳酸钾中的一种或两种;
实验4:将实验3所得混合物过滤后,在沉淀中加入稀硝酸现象结论是一定含有K2SO4、K2CO3两种物质,则说明得到的沉淀是碳酸钡沉淀和硫酸钡沉淀,硫酸钡不溶于稀硝酸,而碳酸钡溶于稀硝酸,故会观察到沉淀部分溶解的现象;
(2)根据实验1,可能含有的物质是氯化钾,要证明氯化钾的存在,可以使用硝酸银溶液,可以将实验④反应的溶液过滤出来,向其中加入硝酸银溶液,若出现白色沉淀,说明含有氯化钾,否则没有;
故答案为:(1)CuCl2、MgCl2;K2SO4、K2CO3;(2)KCl,
实验2:取1所得溶液少许,加入氢氧化钠溶液,没有明显的现象,说明不含有氯化镁,因为氯化镁能与氢氧化钠反应生成氢氧化镁白色沉淀;
实验3:取1所得溶液少许,加入适量硝酸钡溶液,得到了白色沉淀,硫酸钾能与硝酸化钡反应生成硫酸钡沉淀,碳酸钾能与硝酸化钡反应生成碳酸钡沉淀,故白色粉末中一定含有硫酸钾或碳酸钾中的一种或两种;
实验4:将实验3所得混合物过滤后,在沉淀中加入稀硝酸现象结论是一定含有K2SO4、K2CO3两种物质,则说明得到的沉淀是碳酸钡沉淀和硫酸钡沉淀,硫酸钡不溶于稀硝酸,而碳酸钡溶于稀硝酸,故会观察到沉淀部分溶解的现象;
(2)根据实验1,可能含有的物质是氯化钾,要证明氯化钾的存在,可以使用硝酸银溶液,可以将实验④反应的溶液过滤出来,向其中加入硝酸银溶液,若出现白色沉淀,说明含有氯化钾,否则没有;
故答案为:(1)CuCl2、MgCl2;K2SO4、K2CO3;(2)KCl,
| 操 作 | 现 象 | 结 论 |
| 取少量实验④过滤出来的母液于试管中,向试管中滴加硝酸银溶液 | 生成白色沉淀(或无现象) | 原白色粉末中一定没有KCl |
点评:本题考查了常见物质成分的推断,完成此题,可以依据物质的性质以及物质间反应的实验现象和题干提供的信息进行分析得出一定含有和一定没有和可能含有的物质.

练习册系列答案
 优等生题库系列答案
优等生题库系列答案 53天天练系列答案
53天天练系列答案
相关题目