��Ŀ����
����Ŀ��С��ͬѧ��������кͷ�Ӧ��ʵ�飨��ͼ��ʾ������������������Һ�еμ�һ����ϡ�������������������Һ������û�еμ�ָʾ����Ϊ��ȷ���������������Ƶķ�Ӧ�̶ȣ������ձ���ȡ��������Һ���Թ��У������Թ��еμӼ�����ɫ��̪��Һ�����۲쵽�Թ���Һ����ɫû�б仯�����������ձ��е���Һ����������̽����

��1��С����Ϊ��ʱ�ձ��е���Һ�������������������
����������������ǡ����ȫ��Ӧ��������������ʣ�ࣻ��������ʣ��
С��ͬѧȴ�ж�������������������ʣ���������������� ��
��2�����ǹ�ͬ�����һ��ʵ�鷽�������������������ֿ������������֤����������������д�±���
ʵ�鷽�� | ���ܹ۲쵽������ | ���� |
������п�������Թ��У�Ȼ����ձ���ȡ������Һ���Թ��� | ��� | ��������� |
��� | ����������������ǡ����ȫ��Ӧ |
��3���������ۣ�������Ϊ�������м������ʴ���п����Ҳ���Դﵽ��֤Ŀ�ģ�����Ϊ���в���ȷ���� ������ţ���
A����������� B��̼���Ʒ�ĩ C�������Ʒ�ĩ D��������ͭ
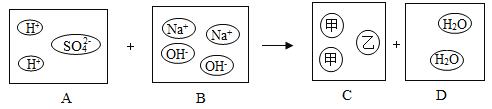
��4�����������ܹ���ʾС������ʵ������ҺpH�仯���Ƶ��� ������ţ���

���𰸡���1���۲쵽�����̪��Һ��ɫ��˵����Һһ�����Լ��ԣ����Բ�����������������ʣ��
��2��������ð����û���������� ��3��C ��4��C
�������������������1��������Һ��ʹ��ɫ��̪��ɺ�ɫ�����Ժ�������Һ������ʹ��̪��ɫ���۲쵽�����̪��Һ��ɫ��˵����Һһ�����Լ��ԣ����Բ�����������������ʣ�ࣻ
��2������п���������������ô������п��Ӧ�����������ܹ۲쵽�������������ݣ���ǡ����ȫ��Ӧ��Ӧ����Һ�����ԣ������пû�����ݲ�����
��3�����Ե�������Ҫ�ɷ����������������������ᷴӦ��̼�������ᷴӦ��������������ݣ�������ͭ�ǹ��壬�����ᷴӦ��C�������Ʋ������ᷴӦ����ѡC��
��4��������������Һ�еμ�һ����ϡ���ᣬ��Һ��ʼ��PH����7��������ϡ�������Һ��PH��ϸ��ǡ����ȫ��Ӧʱ��Һ��PH=7��������ϡ���ᣬ��Һ��PH<7����ѡC��

 ��У����ϵ�д�
��У����ϵ�д�����Ŀ�����и�ѡ������ͼ��ʾ�����������

ѡ�� | ������ | ������ |
A | ��һ����ϡ�����м���п�۵����� | ��Һ����Ԫ�ص����� |
B | ��һ�������������ƺ�̼���ƻ����Һ�м���ϡ��������� | ������������� |
C | ��һ�����ij���ʯ��ˮ�м���̼������Һ������ | ���ɳ��������� |
D | ��һ���¶��£���һ�����IJ������������Һ�м�������ع�������� | ��Һ�����ʵ��������� |
A. A B. B C. C D. D