题目内容
【题目】实验室利用下列装置进行实验
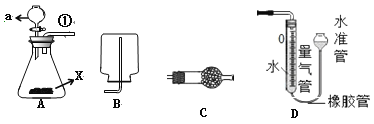
⑴仪器a的名称________,实验室制取氢气,若使用浓盐酸,则管口①导出的气体中有氢气、水蒸气、_______。能用B装置收集氢气,是因为氢气具有 _____的性质。
⑵现有含锌的混合金属粉末X,为测定X的组成,进行了下列实验。
Ⅰ.连接装置A、C、D并检查气密性,向锥形瓶中加入X 3.25g,a中加入50ml(足量)的稀硫酸
Ⅱ.调节量气装置两边液面相平,读取量气管刻度为10ml;
Ⅲ. 打开a的活塞,将稀硫酸全部加入锥形瓶后关闭活塞,充分反应后,冷却到室温
Ⅳ.再次调节量气装置两边液面相平,读取量气管刻度为860ml,此状况下氢气的密度为0.09g/L。
①步骤Ⅳ中调节液面相平的操作是将水准管___________(填“缓慢上移”或“缓慢下移”)。
②产生氢气的体积(__________)
A.860ml B.860-10ml C.860ml-10ml-50ml
③则X中除锌外,可能含有下列的一种金属是(_________)
A.镁 B.铜 C.铁
⑶根据化学方程式计算:31.6g的高锰酸钾加热后最多能产生___________克的氧气?
【答案】 分液漏斗 氯化氢 (或HCl) 密度比空气小,不与空气反应 缓慢下移 C B 3.2g
【解析】⑴仪器a的名称分液漏斗,实验室制取氢气,若使用浓盐酸,盐酸有挥发性,易会发出溶质氯化氢,则管口①导出的气体中有氢气、水蒸气、氯化氢。能用B装置收集氢气,是因为氢气具有密度比空气小,不与空气反应的性质;⑵①由于生成氢气,使装置A内压强增大,量气管内液面下降,步骤Ⅳ中调节液面相平的操作是将水准管缓慢下移,使液面向平,调整A内压强等于大气压,②产生氢气的体积860-10ml=850ml;③试验中生成氢气的质量为:0.850L×0.09g/L=0.0765g,锌和氢气的质量比为65:2,则3.25g锌完全反应,能生成氢气0.1g,镁、铁都比同质量的锌生成氢气多,而铜不与酸反应,不能生成氢气,则X中除锌外,可能含有一种金属是铜; ⑶设31.6g的高锰酸钾加热后最多能产生氧气的质量为x
2KMnO4![]() K2MnO4+MnO2+O2↑
K2MnO4+MnO2+O2↑
316 32
31.6g x
![]()
X=3.2g
答:31.6g的高锰酸钾加热后最多能产生氧气的质量为3.2g。

 互动英语系列答案
互动英语系列答案 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案