题目内容
【题目】某化学学习小组对胃药“碳酸氢钠片”进行了探究,具体做法如下:
步骤1:取1片胃药研碎放入锥形瓶中,加水完全溶解得到100g溶液;
步骤2:配制100g0.365%的稀盐酸作为模拟胃酸;
步骤3:取步骤1中的溶液20g于锥形瓶中,向锥形瓶内逐滴滴加上述稀盐酸并用传感器测定溶液的pH,当pH等于7时恰好反应,消耗稀盐酸10g(胃药中其它成分不参加反应)。
请回答下列问题:
(1)NaHCO3中碳、氧元素的质量比为_____(写最简整数比)。
(2)用18.25%的浓盐酸配制100g0.365%的稀盐酸需加水_____mL
(3)请根据实验数据计算每片胃药中NaHCO3的质量,写出必要的计算过程。_____
【答案】1:4 98 0.42g
【解析】
(1)NaHCO3中碳、氧元素的质量比为12:16×3=1:4。
(2)设用18.25%的浓盐酸的质量为x,
100g×0.365%=x×18.25%,得x=2g。
则需要水的质量为100g-2g=98g,即98mL水。
(3)设每片胃药中NaHCO3的质量为y,
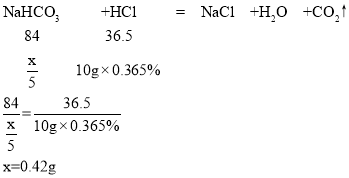
答:每片胃药中NaHCO3的质量为0.42g。

练习册系列答案
相关题目
【题目】下列选用的除杂试剂和实验操作都正确的是(括号内为杂质)
选项 | 物质 | 除杂选用的试剂和操作 |
A | NaCl固体(Na2CO3)固体 | 加入足量盐酸,搅拌至充分反应,蒸发结晶 |
B | KCl固体(KClO3)固体 | 加入少量的MnO2,加热 |
C | CO2(CO) | 通入足量氧气,点燃 |
D | NaNO3溶液(NaOH溶液) | 加入适量CuSO4溶液,过滤 |
A. AB. BC. CD. D