题目内容
【题目】计算:多少克高锰酸钾分解产生的氧气与电解1.8g水产生的氧气质量相等?
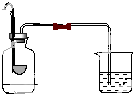
【答案】解:由反应的化学方程式:2H2O ![]() 2H2↑+O2↑,2KMnO4
2H2↑+O2↑,2KMnO4![]() K2MnO4+MnO2+O2↑可知,
K2MnO4+MnO2+O2↑可知,
则产生等质量的氧气,所消耗的水和高锰酸钾的关系为H2O~KMnO4 , 即所消耗的水和高锰酸钾的质量比为18:158,设需要高锰酸钾的质量为x
H2O~KMnO4 ,
18 158
1.8g x![]() =
= ![]()
x=15.8g
故答案为:15.8g.
【解析】根据高锰酸钾在加热条件下生成锰酸钾、二氧化锰和氧气,水通电分解生成氢气和氧气,由参加反应的氧气的质量,计算出生成氧气的质量,由生成氧气的质量,由反应的化学方程式计算出需要高锰酸钾的质量即可.
【考点精析】解答此题的关键在于理解根据化学反应方程式的计算的相关知识,掌握各物质间质量比=系数×相对分子质量之比.

练习册系列答案
相关题目