题目内容
【题目】水是生命之源,人类的生活生产离不开水。
(1)自来水属于_____(填“纯净物”或“混合物”)。检验自来水是硬水还是软水,可选用的物质是_____。生活中既能降低水的硬度,又能杀菌消毒的方法是_____。
(2)某同学收集到一杯有臭味的混浊污水,先用滤纸进行过滤,过滤时所用的玻璃仪器有烧杯、玻璃棒和_____,过滤后发现水虽然变清,但是依然有臭味,能够除去臭味的方法是_____。
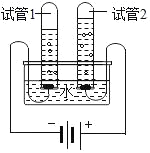
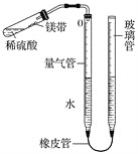
(3)该同学为了探究水的组成,做了水的电解实验,如图所示。写出该反应的文字表达式:_____,实验开始后发现两极都有_____冒出,试管1中的气体是_____;试管2中的气体能_____,是_____。
(4)此实验能够证明水是由_____组成的。
【答案】混合物 肥皂水 加热煮沸 漏斗 用活性炭吸附 水![]() 氢气+氧气 气泡 氢气 使带火星木条复燃 氧气 氢、氧两种元素组成
氢气+氧气 气泡 氢气 使带火星木条复燃 氧气 氢、氧两种元素组成
【解析】
(1)自来水含有水和矿物质,属于混合物;区分硬水和软水的方法是:用肥皂水,泡沫少、浮渣多的为硬水,泡沫多、浮渣少的为软水;生活中既能降低水的硬度,又能杀菌消毒的方法是加热煮沸的方法;
(2)过滤用到的仪器有:铁架台、烧杯、玻璃棒和漏斗;活性炭具有吸附作用能吸附色素和异味;
(3)水在通电的条件下生成氢气和氧气,并且是正极产生氧气,负极产生氢气,氧气能够使带火星的木条复燃;根据化学反应前后元素的种类不变,证明水是由氢氧两种元素组成。

 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案【题目】某学习小组在帮助实验员整理化学试剂时发现了一瓶标签残缺的无色溶液,(如图所示),经实验员分析可知原瓶溶液中的溶质可能是 NaHCO3,NaOH,Na2CO3,NaCl中的一种,请你对该试剂作出猜想并进行实验探究:
(提出问题)这瓶试剂是什么溶液?
(猜想与假设)
甲猜想:NaHCO3溶液
乙猜想:NaOH溶液
丙猜想:Na2CO3溶液
丁猜想:NaCl溶液
(查阅资料)上述四种物质相关信息如下
物质 | NaHCO3 | NaOH | Na2CO3 | NaCl |
常温下溶解度/g | 9.6 | 109 | 21.5 | 36 |
常温下稀溶液的pH | 9 | 13 | 11 | 7 |
(实验探究1)取瓶中溶液少许于试管中,滴加几滴酚酞溶液,溶液变红。
(实验探究2)另取瓶中溶液少许于试管中,滴加足量的稀盐酸,产生生气泡。
(实验分析)通过(实验探究1)可知_____同学的猜想一定错误。
甲同学仔细分析四种物质的相关信息表后发现自已的猜想错误,他的理由是_____。
丙同学分析(实验探究2)并结合以上同学的实验结论,认为原瓶溶液是NaCO3溶液。
(实验探究2)中发生反应的化学方程式为_____。
(讨论质疑)乙认为以上同学分析有漏洞,需要进一步实验确定,于是又进行了如下探究。
(实验探究3)在(实验探究1)试管中的红色溶液中滴加过量氯化钙溶液(中性),充分反应后,试管中溶液仍呈红色,但有白色沉淀产生。
(得出结论)通过(实验探究3)可证明这瓶试剂为_____溶液,但已经部分变质。
(反思与拓展)学习小组反思了这瓶试剂因为_____而变质,得出了该溶液正确的保存方法,若要除去该溶液变质部分所采用的方法是_____(用化学反应方程式表示)。

【题目】《千里江山图》是北宋王希孟创作的绢本设色画,其颜料选用各色天然矿石,描绘了祖国的锦绣河山。一些矿石的主要成分及颜色如下表。

矿石 | 蓝铜矿 | 孔雀石 | 雌黄 | 赭石 |
主要成分 | Cu3(OH)2(CO3)2 | Cu(OH)CO | As2S3 | Fe2O3 |
颜色 | 蓝色 | 绿色 | 黄色 | 红色 |
(1)四种矿石主要成分中,属于氧化物的是______。
(2)蓝铜矿和孔雀石的主要成分在组成上具有的相同点是______。
【题目】某校化学兴趣小组参观制碱厂后,获得以下信息并对相关问题进行研究.
产品原理:该厂采用“侯氏制碱法”生产化工产品﹣﹣纯碱(Na2CO3)和化肥NH4Cl.
生产原理是:将NH3和CO2通入饱和食盐水中得到NaHCO3晶体和NH4Cl溶液,反应的化学方程式为:_____;后分离出NaHCO3,加热制得纯碱.
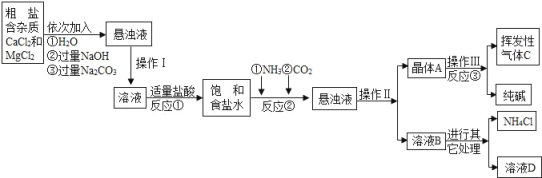
生产流程:
相关资料:
(1)NH4Cl ![]() NH3↑+HCl↑
NH3↑+HCl↑
(2)已知20℃时有关物质的溶解度如下(气体指1体积水中能溶解的气体体积)
物质 | NaCl | NaHCO3 | NH4Cl | NH3 | CO2 |
溶解度 | 36.0g | 9.6g | 37.2g | 710 | 0.9 |
问题讨论:
(1)操作Ⅰ、Ⅱ中,相同操作的名称为_____.反应①中发生了两个反应,写出其中一个化学方程式:_____,反应①加适量的盐酸,适量是指_____.
(2)检验挥发性气体C的方法_____.
(3)上述生产流程中可循环使用的是_____(填序号).
A挥发性气体C; B溶液D; C氢氧化镁;D化肥NH4Cl
组成确定:
(1)称取一定质量的纯碱样品,经多次充分加热后,再称重,质量无变化;
(2)另取少量纯碱样品加入适量水,样品完全溶解,向该溶液中加入过量稀HNO3,再滴加AgNO3溶液,有白色沉淀.由上述实验可确定纯碱样品含有杂质_____(写化学式).
含量测定:
实验一 | 实验二 | 实验三 | 实验四 | |
固体混合物溶液质量 | 100g | 100g | 100g | 100g |
加入CaCl2溶液质量 | 10g | 20g | 30g | 40g |
生成的沉淀的质量 | 4g | m | 10g | 10g |
称取该纯碱样品44g固体混合物,加水配成400g溶液,平均分为四份,然后分别加入一定质量分数的CaCl2溶液,实验数据见表:
请分析表中数据回答并计算:
(1)m=_____g;
(2)在实验三中,完全反应后所得溶液中溶质氯化钠的质量分数是多少?_____(要求写计算过程,结果保留0.1%)
总结反思:
请通过计算并结合下表判断此纯碱样品等级为_____品,在上述纯碱含量测定中,将CaCl2溶液改为BaCl2溶液,测定误差会减小.
工业纯碱标准:(Na2CO3% ) | |||
优等品 | 一等品 | 合格品 | 次品 |
≥95 | ≥80 | ≥75 | ≤40 |