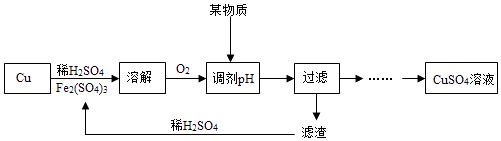
题目内容
【题目】某无色气体中可能含有CO、CO2、H2、N2中的一种或几种,现将该气体通过下图所示装置,观察到Ⅰ:A装置内未见浑浊出现;Ⅱ:D装置内无水硫酸铜变蓝;
Ⅲ:E装置无明显现象;最终收集到一定量干燥气体(假设每步反应完全,浓硫酸具有吸水性)。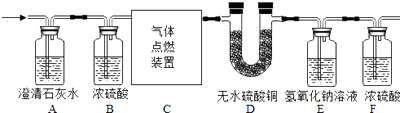
请回答下列问题:
① 由Ⅰ可知混合气体中肯定不含有;
② 由Ⅱ可知混合气体中肯定含有;
③ 最终收集到的气体是;
④ 为了确定该混合气体的最终组成,还需补充的实验或改进的操作是。
【答案】CO2;H2;N2;将E中氢氧化钠溶液改成澄清石灰水(或称量反应前后E装置的质量)
【解析】A装置内未见浑浊出现说明I中肯定不含有CO2;D装置内无水硫酸铜变蓝,说明气体燃烧生成H2O,则肯定含有H2,E装置无明显现象,最终收集到一定量干燥气体为N2,E中氢氧化钠无明显现象,故通过现象不能推断是否有CO,CO 燃烧生成CO2与氢氧化钠无明显现象,故气体肯是CO和H2、N2;故为了确定该混合气体的最终组成,必须要检验E中发生了反应。还需补充的实验或改进的操作是将E中氢氧化钠溶液改成澄清石灰水。
所以答案是:CO2;H2;N2;将E中氢氧化钠溶液改成澄清石灰水(或称量反应前后E装置的质量)。

练习册系列答案
相关题目