题目内容
【题目】下列关于质量相同的 SO2 和 SO3 的叙述正确的是( )
A. SO2 和 SO3 分子个数比是 5:4
B. 氧原子的个数比为 2:3
C. 硫元素的质量比为 1:1
D. 氧元素的质量比为 4:5
【答案】A
【解析】
A、质量相同的SO2和SO3,它们的分子数之比等于质量除以相对分子质量之比;
B、用化合物的质量乘以某元素的质量分数等于某元素的质量,本题是求氧原子的个数比,因是同种元素,则含氧原子的个数之比即为氧元素的质量之比;
C、考虑相同质量的SO2与SO3中硫元素的质量比等于SO2与SO3中硫元素的质量分数之比,结合物质中某元素的质量分数=![]() ×100%,进行分析;
×100%,进行分析;
D、根据化合物中某元素的质量=该化合物的质量×该元素的质量分数,进行分析解答。
A、设相同的质量为m,质量相同的SO2和SO3,它们的分子数之比: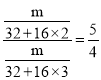 故符合题意;
故符合题意;
B、可设SO2和SO3的质量都是m,则SO2中氧元素的质量为:m×![]() ×100%=0.5m,SO3中所含氧氧元素的质量为:m×
×100%=0.5m,SO3中所含氧氧元素的质量为:m×![]() ×100%=0.6m,则相同质量的SO2和SO3中所含氧原子的个数之比是:0.5m:0.6m=5:6,故不符合题意;
×100%=0.6m,则相同质量的SO2和SO3中所含氧原子的个数之比是:0.5m:0.6m=5:6,故不符合题意;
C、设SO2和SO3的质量都1g,则硫元素的质量比是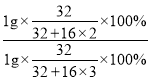 =5:4,故不符合题意;
=5:4,故不符合题意;
D、相同质量的SO2和SO3,设它们的质量均为m,所含氧元素的质量比为(m×![]() ×100%):(m×
×100%):(m×![]() ×100%)=5:6,故不符合题意。
×100%)=5:6,故不符合题意。

 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案【题目】某兴趣小组对KClO3分解反应的催化剂进行研究,在相同的加热条件下,用如图装置完成表中实验:
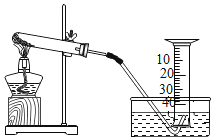
编号 | KClO3质量/g | 催化剂 | 催化剂质量/g | 收集50 mL O2所需时间/s |
实验1 | 5 | - | - | 171 |
实验2 | 5 | MnO2 | 0.5 | 49 |
实验3 | 5 | Fe2O3 | 0.5 | 58 |
实验4 | 5 | KCl | 0.5 | 154 |
(1)设置实验1的目的是________。
(2)表中所列3种催化剂的催化效果最佳的是_____。
(3)写出KClO3分解的符号表达式:______________________。
(4)由实验1和实验4可知,KCl__(填“有”或“无”)催化作用。维持加热条件不变,用实验1再继续收集50 mL O2,所需时间明显少于171 s,解释原因:_______。
(5)要比较KClO3分解反应中不同催化剂的催化效果,除了测量收集50 mL O2所需时间外,还可以测量相同时间内____________。