题目内容
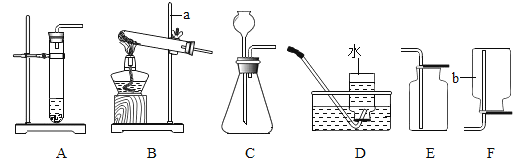
【题目】Ⅰ.下列是实验室制取气体的一些装置图,请根据要求回答:
(1)实验室用高锰酸钾做原料制氧气的化学方程式为 , 可选用的发生装置是(填字母序号)。
(2)实验室制取并收集一瓶干燥的二氧化碳气体,化学反应方程式为。按照气流自左至右方向流动,所用仪器按连接顺序依次为(填字母顺序)。
(3)实验室若用5%的过氧化氢溶液与二氧化锰混合来制取氧气。要配制5%的过氧化氢溶液600g,需要质量分数为30%的过氧化氢溶液(密度为1.1g/cm3)mL(计算结果保留一位小数)。稀释过氧化氢溶液的主要步骤有:计算、、稀释、装瓶并贴标签。
(4)Ⅱ.下列是某化学小组探究物质组成与性质的实验装置图,根据要求回答:
上述实验设计中有错误的是(填字母序号),A中可燃物应取过量的原因是。
(5)B中玻璃棒搅拌的目的是 , C中会出现的实验现象为。
(6)D中硬质玻璃管内发生反应的化学方程式为 , 酒精灯的作用是。
【答案】
(1)2KMnO4 ![]() K2MnO4+ MnO2+ O2↑,B
K2MnO4+ MnO2+ O2↑,B
(2)CaCO3+2HCl= CaCl2+H2O+ CO2↑,AFD
(3)90.9mL,量取
(4)AB,将广口瓶内氧气全部耗尽
(5)散热,U型管内液面a高b低
(6)3CO+Fe2O3 ![]() 2Fe+3CO2,消除尾气
2Fe+3CO2,消除尾气
【解析】解:Ⅰ.(1)高锰酸钾在加热条件下分解生成锰酸钾、二氧化锰、氧气,化学方程式为2KMnO4 ![]() K2MnO4+ MnO2+ O2↑;(2) 实验室常用石灰石和盐酸制取二氧化碳,是固液常温型,选发生装置A;用盛有浓硫酸的F装置干燥。二氧化碳的密度比空气的大,用装置D收集。所用仪器按连接顺序依次为AFD;(3)稀释过程中溶质的质量分数不变,设需要质量分数为30%的过氧化氢溶液的体积为v, 5%×600g=30%=v×1.1g/cm3×30% v=90.9mL ;稀释过氧化氢溶液的主要步骤有:计算、量取、稀释、装瓶并贴标签。Ⅱ.(4) 上述实验设计中有错误的是AB,测定空气中氧气含量的原理是,利用物质与空气中的氧气反应,又不生成气体,使瓶内气体减 少,压强变小,水倒流入集气瓶内,倒流的水的体积就等于瓶内氧气的体积。木炭燃烧会生成气体,所以不能用于测定空气中氧气的含量;稀释浓硫酸时应将浓硫酸沿器壁慢慢注入水中,切不可将水注入浓硫酸里,否则会导致酸液飞溅。可燃物应取过量的原因是使装置内氧气被消耗更充分反应,测定结果更准确;(5)浓硫酸溶于水会放出大量的热,B中玻璃棒搅拌的目的是使热量及时扩散,防止液体沸腾导致酸液飞溅,C中会出现的实验现象为铁生锈,并且由于生锈消耗氧气,使装置内氧气的量减少,压强变小,所以U型管内液面a高b低;(6)D中硬质玻璃管内发生反应的化学方程式为3CO+Fe2O3
K2MnO4+ MnO2+ O2↑;(2) 实验室常用石灰石和盐酸制取二氧化碳,是固液常温型,选发生装置A;用盛有浓硫酸的F装置干燥。二氧化碳的密度比空气的大,用装置D收集。所用仪器按连接顺序依次为AFD;(3)稀释过程中溶质的质量分数不变,设需要质量分数为30%的过氧化氢溶液的体积为v, 5%×600g=30%=v×1.1g/cm3×30% v=90.9mL ;稀释过氧化氢溶液的主要步骤有:计算、量取、稀释、装瓶并贴标签。Ⅱ.(4) 上述实验设计中有错误的是AB,测定空气中氧气含量的原理是,利用物质与空气中的氧气反应,又不生成气体,使瓶内气体减 少,压强变小,水倒流入集气瓶内,倒流的水的体积就等于瓶内氧气的体积。木炭燃烧会生成气体,所以不能用于测定空气中氧气的含量;稀释浓硫酸时应将浓硫酸沿器壁慢慢注入水中,切不可将水注入浓硫酸里,否则会导致酸液飞溅。可燃物应取过量的原因是使装置内氧气被消耗更充分反应,测定结果更准确;(5)浓硫酸溶于水会放出大量的热,B中玻璃棒搅拌的目的是使热量及时扩散,防止液体沸腾导致酸液飞溅,C中会出现的实验现象为铁生锈,并且由于生锈消耗氧气,使装置内氧气的量减少,压强变小,所以U型管内液面a高b低;(6)D中硬质玻璃管内发生反应的化学方程式为3CO+Fe2O3 ![]() 2Fe+3CO2,酒精灯的作用是点燃尾气中的一氧化碳,防止污染空气;
2Fe+3CO2,酒精灯的作用是点燃尾气中的一氧化碳,防止污染空气;
所以答案是:(1)2KMnO4 K2MnO4+ MnO2+ O2↑;(2)AFD;(3)90.9mL ;量取;(4)AB;将广口瓶内氧气全部耗尽;(5)散热;U型管内液面a高b低;(6)3CO+Fe2O3![]() 2Fe+3CO2;消除尾气.
2Fe+3CO2;消除尾气.
【考点精析】认真审题,首先需要了解一氧化碳的性质(一氧化碳的物理性质:无色,无味的气体,密度比空气略小,难溶于水;一氧化碳的化学性质:可燃性和还原性),还要掌握一氧化碳的毒性(有毒:吸进肺里与血液中的血红蛋白结合,使人体缺少氧气而中毒)的相关知识才是答题的关键.