题目内容
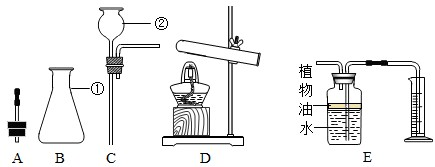
实验是实现科学探究的重要途径.请回答以下有关化学实验的问题.如图是实验制取气体的常用装置.
(1)请写出用A装置制取氧气的化学方程式.
(2)将B、C装置连接后可制取多种气体,请写出制取二氧化碳气体的化学方程式.
(3)由上述两题可知,当我们选择发生装置应主要考虑哪些因素?
(4)收集二氧化碳时不宜用E装置,其原因是什么?
(5)所以当我们选择收集装置时,应主要考虑哪些因素?
(6)实验室之所以不用高温煅烧石灰石(CaCO3
CO2↑+CaO)的方法制取二氧化碳,原因是?
(7)取12g石灰石(主要成分是CaCO3,杂质不参加反应)放入烧杯中,向其中加入100g一定质量分数的稀盐酸,二者恰好完全反应.反应结束后,称量烧杯中剩余物质的总质量为107.6g(不包括烧杯的质量,且气体溶解忽略不计).则参加反应的碳酸钙的质量是多少?

(1)请写出用A装置制取氧气的化学方程式.
(2)将B、C装置连接后可制取多种气体,请写出制取二氧化碳气体的化学方程式.
(3)由上述两题可知,当我们选择发生装置应主要考虑哪些因素?
(4)收集二氧化碳时不宜用E装置,其原因是什么?
(5)所以当我们选择收集装置时,应主要考虑哪些因素?
(6)实验室之所以不用高温煅烧石灰石(CaCO3
| ||
(7)取12g石灰石(主要成分是CaCO3,杂质不参加反应)放入烧杯中,向其中加入100g一定质量分数的稀盐酸,二者恰好完全反应.反应结束后,称量烧杯中剩余物质的总质量为107.6g(不包括烧杯的质量,且气体溶解忽略不计).则参加反应的碳酸钙的质量是多少?
分析:(1)A装置是用加热固体的方法制取氧气,且试管口有棉花,说明是用加热高锰酸钾的方法制取氧气,据反应原理书写方程式;
(2)实验室制取二氧化碳用大理石和稀盐酸反应,二者反应生成氯化钙、水和二氧化碳;
(3)由上述两题可知:选择发生装置时通常考虑反应物的状态和反应条件;
(4)二氧化碳能溶于水,所以不宜用排水法收集;
(5)选择收集装置通常考虑气体的密度和溶解性;
(6)高温煅烧石灰石需要反应条件高温,实验室不易达到,操作复杂;
(7)据质量守恒定律,可知:反应前后减少的质量就是生成的二氧化碳的质量,由反应前后质量差计算出生成二氧化碳的质量;并根据反应的化学方程式计算参加反应的碳酸钙的质量.
(2)实验室制取二氧化碳用大理石和稀盐酸反应,二者反应生成氯化钙、水和二氧化碳;
(3)由上述两题可知:选择发生装置时通常考虑反应物的状态和反应条件;
(4)二氧化碳能溶于水,所以不宜用排水法收集;
(5)选择收集装置通常考虑气体的密度和溶解性;
(6)高温煅烧石灰石需要反应条件高温,实验室不易达到,操作复杂;
(7)据质量守恒定律,可知:反应前后减少的质量就是生成的二氧化碳的质量,由反应前后质量差计算出生成二氧化碳的质量;并根据反应的化学方程式计算参加反应的碳酸钙的质量.
解答:解:(1)A装置是用加热固体的方法制取氧气,且试管口有棉花,说明是用加热高锰酸钾的方法制取氧气,反应方程式是:2KMnO4
K2MnO4+MnO2+O2↑;
(2)实验室制取二氧化碳用大理石和稀盐酸反应,二者反应生成氯化钙、水和二氧化碳,方程式是:CaCO3+2HCl=CaCl2+H2O+CO2↑;
(3)由上述两题可知:选择发生装置时通常考虑反应物的状态和反应条件;
(4)二氧化碳能溶于水,所以不宜用排水法收集;
(5)二氧化碳能溶于水,不能用排水法收集,其密度比空气大,故可用向上排空气法收集,由此可知:选择收集装置通常考虑气体的密度和溶解性;
(6)高温煅烧石灰石需要反应条件高温,实验室不易达到,且操作复杂;
(7)根据质量守恒定律,恰好完全反应后生成二氧化碳的质量=100g+12g-107.6g=4.4g;
设参加反应的碳酸钙的质量为x
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 4.4g
=
x=10g
答:参加反应的碳酸钙的质量是10g;
故答案为:(1)2KMnO4
K2MnO4+MnO2+O2↑;
(2)CaCO3+2HCl=CaCl2+H2O+CO2↑;
(3)选择发生装置时考虑反应物的状态和反应条件;
(4)二氧化碳能溶于水,所以不宜用排水法收集;
(5)选择收集装置通常考虑气体的密度和溶解性;
(6)条件高温,实验室不易达到,且操作复杂;
(7)参加反应的碳酸钙的质量是10g.
| ||
(2)实验室制取二氧化碳用大理石和稀盐酸反应,二者反应生成氯化钙、水和二氧化碳,方程式是:CaCO3+2HCl=CaCl2+H2O+CO2↑;
(3)由上述两题可知:选择发生装置时通常考虑反应物的状态和反应条件;
(4)二氧化碳能溶于水,所以不宜用排水法收集;
(5)二氧化碳能溶于水,不能用排水法收集,其密度比空气大,故可用向上排空气法收集,由此可知:选择收集装置通常考虑气体的密度和溶解性;
(6)高温煅烧石灰石需要反应条件高温,实验室不易达到,且操作复杂;
(7)根据质量守恒定律,恰好完全反应后生成二氧化碳的质量=100g+12g-107.6g=4.4g;
设参加反应的碳酸钙的质量为x
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 4.4g
| 100 |
| 44 |
| x |
| 4.4g |
x=10g
答:参加反应的碳酸钙的质量是10g;
故答案为:(1)2KMnO4
| ||
(2)CaCO3+2HCl=CaCl2+H2O+CO2↑;
(3)选择发生装置时考虑反应物的状态和反应条件;
(4)二氧化碳能溶于水,所以不宜用排水法收集;
(5)选择收集装置通常考虑气体的密度和溶解性;
(6)条件高温,实验室不易达到,且操作复杂;
(7)参加反应的碳酸钙的质量是10g.
点评:本题考查知识比较综合,既考查了装置选择的依据,又考查了制取气体的反应原理、据方程式的计算等知识,掌握相关知识才能正确解答.

练习册系列答案
相关题目
实验是实现科学探究的重要途径.请回答以下有关化学实验的问题.
(1)下列实验操作中不正确的是 (填标号).
①制备气体前检查装置的气密性②加热实验结束时,用嘴吹灭酒精灯.
③将用剩的药品放回原试剂瓶中④稀释浓硫酸时,将浓硫酸沿器壁缓慢注入水中.
(2)在实验室里,可用浓盐酸与二氧化锰在加热条件下起反应制取氯气(Cl2),该气体能溶于水,则制取氯气应选择的发生装置和收集装置分别是 (填标号).
(3)某兴趣小组设计的趣味小实验装置如右图所示,其中A、B为未膨胀的气球,C为玻璃导管,D为胶头滴管.用气密性良好的该装置分别进行甲、乙两组实验.实验时均把胶头滴管中的溶液(足量)加入到锥形瓶中,并轻轻振荡.请填写下表中的空白: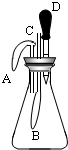
(4)取12g石灰石(主要成分是CaCO3,杂质不参加反应)放入烧杯中,向其中加入100g一定质量分数的稀盐酸,二者恰好完全反应.反应结束后,称量烧杯中剩余物质的总质量为107.6g(不包括烧杯的质量,且气体溶解忽略不计).则参加反应的碳酸钙的质量是多少?稀盐酸中溶质的质量分数是多少?
(1)下列实验操作中不正确的是
①制备气体前检查装置的气密性②加热实验结束时,用嘴吹灭酒精灯.
③将用剩的药品放回原试剂瓶中④稀释浓硫酸时,将浓硫酸沿器壁缓慢注入水中.
(2)在实验室里,可用浓盐酸与二氧化锰在加热条件下起反应制取氯气(Cl2),该气体能溶于水,则制取氯气应选择的发生装置和收集装置分别是

(3)某兴趣小组设计的趣味小实验装置如右图所示,其中A、B为未膨胀的气球,C为玻璃导管,D为胶头滴管.用气密性良好的该装置分别进行甲、乙两组实验.实验时均把胶头滴管中的溶液(足量)加入到锥形瓶中,并轻轻振荡.请填写下表中的空白:

| 锥形瓶中的物质 | 胶头滴管中的物质 | 观察到气球(A、B)的变化 | 有关反应的化学方程式 | |
| 甲 | 二氧化碳 | 浓氢氧化钠溶液 | ||
| 乙 | A气球胀大 B气球无明显变化 |