题目内容
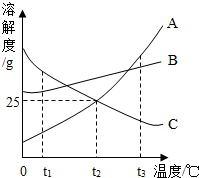 (2013?淮安)如图所示是A、B、C三种物质的溶解度曲线,据此图回答:
(2013?淮安)如图所示是A、B、C三种物质的溶解度曲线,据此图回答:(1)t1℃时,A、B、C三种物质的溶解度由大到小的顺序是
C>B>A
C>B>A
;(2)t2℃时,将30gA放入100g水中,充分搅拌后,所得溶溶液的溶质质量分数是
20%
20%
;(3)t3℃时,将等质量A、B两种物质的饱和溶液降温到t2℃时,析出晶体质量较大的是
A
A
; (4)t3℃时,将25gC放入100g水中,充分搅拌后得到C的饱和溶液,在不改变溶剂量的前提下,将其变为不饱和溶液的方法是
降温至低于t2℃
降温至低于t2℃
.分析:(1)据溶解度曲线可比较同一温度下不同物质的溶解度大小;
(2)据t2℃时A的溶解度及溶液中溶质的质量分数的计算式分析解答;
(3)一定温度范围内,等质量的饱和溶液降温相同温度溶解度变化幅度越大,则析出晶体越多;
(3)据C的溶解度随温度变化情况分析解答.
(2)据t2℃时A的溶解度及溶液中溶质的质量分数的计算式分析解答;
(3)一定温度范围内,等质量的饱和溶液降温相同温度溶解度变化幅度越大,则析出晶体越多;
(3)据C的溶解度随温度变化情况分析解答.
解答:解:(1)t1℃时,A、B、C三种物质的溶解度由大到小的顺序是:C>B>A;
(2)t2℃时,A的溶解度是25g,所以将30gA放入100g水中,充分搅拌后,不会全部溶解,最多溶解25g,所得溶溶液的溶质质量分数是:
×100%=20%;
(3)t3℃~t2℃,A的溶解度变化幅度比B大,所以将等质量A、B两种物质的饱和溶液降温到t2℃时,析出晶体质量较大的是A;
(4)饱和溶液变为不饱和溶液的一般方法是降温、蒸发溶剂,C的溶解度随温度的降低而增大,t3℃时,将25gC放入100g水中,充分搅拌后得到C的饱和溶液,要在不改变溶剂量的前提下,将其变为不饱和溶液,应采取降温的方法,t2℃时,C的溶解度是25g,即降温至t2℃时恰好饱和,所以应降至t2℃时以下;
故答案为:(1)C>B>A;(2)20%;(3)A;(4)降温至低于t2℃.
(2)t2℃时,A的溶解度是25g,所以将30gA放入100g水中,充分搅拌后,不会全部溶解,最多溶解25g,所得溶溶液的溶质质量分数是:
| 25g |
| 125g |
(3)t3℃~t2℃,A的溶解度变化幅度比B大,所以将等质量A、B两种物质的饱和溶液降温到t2℃时,析出晶体质量较大的是A;
(4)饱和溶液变为不饱和溶液的一般方法是降温、蒸发溶剂,C的溶解度随温度的降低而增大,t3℃时,将25gC放入100g水中,充分搅拌后得到C的饱和溶液,要在不改变溶剂量的前提下,将其变为不饱和溶液,应采取降温的方法,t2℃时,C的溶解度是25g,即降温至t2℃时恰好饱和,所以应降至t2℃时以下;
故答案为:(1)C>B>A;(2)20%;(3)A;(4)降温至低于t2℃.
点评:本题主要考查 了学生对溶解度概念的认识、溶质质量分数的考查、重点是溶解度曲线的意义的应用,能很好考查学生对知识的理解和应用.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
 (2013?淮安二模)根据所学知识回答下列问题.
(2013?淮安二模)根据所学知识回答下列问题.