题目内容
某家里蒸馒头用的纯碱中含有少量的氯化钠,某实验小组要测定该纯碱中碳酸钠的含量.现将该纯碱样品8g,加入136.7g某盐酸溶液恰好完全反应,同时产生了2.2g气体.试计算:(1)纯碱样品中碳酸钠的质量.
(2)反应后所得氯化钠溶液的溶质质量分数.
【答案】分析:根据气体的质量代入碳酸钠与盐酸反应的化学反应方程式来计算碳酸钠的质量,然后计算样品中的纯度,根据生成的氯化钠的质量和样品中氯化钠的质量计算反应后溶质的总质量,利用质量守恒计算反应后溶液的质量,最后计算溶质的质量分数.
解答:解:(1)设样品中碳酸钠的质量为x,与盐酸反应生成的氯化钠为y,则
Na2CO3+2HCl═2NaCl+CO2↑+H2O
106 117 44
x y 2.2g
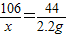 ,
,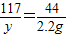
解得x=5.3g,y=5.85g
答:纯碱样品中碳酸钠的质量为5.3g
(2)溶液中氯化钠的质量为:5.85g+(8g-5.3g)=8.55g,
溶液的质量为:8g+136.7g-2.2g=142.5g
则反应后所得氯化钠溶液的溶质质量分数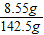 ×100%=6%,
×100%=6%,
答:反应后所得氯化钠溶液的溶质质量分数为6%.
点评:本题考查学生利用化学反应方程式的计算,利用二氧化碳的质量代入计算是关键,学生还应熟悉质量分数的计算.
解答:解:(1)设样品中碳酸钠的质量为x,与盐酸反应生成的氯化钠为y,则
Na2CO3+2HCl═2NaCl+CO2↑+H2O
106 117 44
x y 2.2g
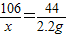 ,
,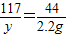
解得x=5.3g,y=5.85g
答:纯碱样品中碳酸钠的质量为5.3g
(2)溶液中氯化钠的质量为:5.85g+(8g-5.3g)=8.55g,
溶液的质量为:8g+136.7g-2.2g=142.5g
则反应后所得氯化钠溶液的溶质质量分数
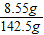 ×100%=6%,
×100%=6%,答:反应后所得氯化钠溶液的溶质质量分数为6%.
点评:本题考查学生利用化学反应方程式的计算,利用二氧化碳的质量代入计算是关键,学生还应熟悉质量分数的计算.

练习册系列答案
相关题目