题目内容
【题目】达州某中学的化学兴趣小组的同学利用如图所示装置测定Fe2O3样品中Fe2O3质量分数,(样品中杂质不反应),回答下列问题.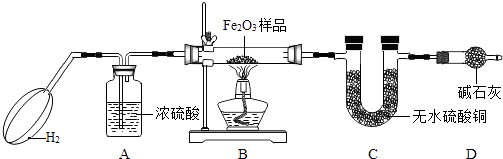
(1)实验开始时,挤压气球并持续一段时间,其目的是
(2)装置A的作用是 , 装置C中的现象是
(3)反应前准确称得样品Fe2O3质量为5g,完全反应后装置C质量增加了1.35g,则样品中Fe2O3的质量分数为
(4)若省去D装置,则实验测得的样品中Fe2O3质量分数会(填“偏大”或“偏小”或“不变”)
【答案】
(1)除去装置中的空气,防止加热时发生爆炸
(2)干燥氢气,白色粉末逐渐变蓝
(3)80%
(4)偏大
【解析】解:(1)因为氢气具有可燃性,装置内有空气时会发生爆炸;(2)浓硫酸具有吸水性,A装置盛的是浓硫酸,作用是干燥氢气;氢气与氧化铁反应会生成水,无水硫酸铜遇水变蓝.(3)因为C中增加的质量是生成水的质量1.35g,其中氧元素的质量是1.35g× ![]() =1.2g,Fe2O3的质量1.2g÷
=1.2g,Fe2O3的质量1.2g÷ ![]() =4g,则样品中Fe2O3的质量分数为
=4g,则样品中Fe2O3的质量分数为 ![]() ×100%=80%,所以答案是:80%(4)如果没有D装置,空气中的水蒸气会进入U形管,被无水硫酸铜所吸收,导致水的质量增大,结果使求得的样品中Fe2O3的质量分数比实际的偏大.
×100%=80%,所以答案是:80%(4)如果没有D装置,空气中的水蒸气会进入U形管,被无水硫酸铜所吸收,导致水的质量增大,结果使求得的样品中Fe2O3的质量分数比实际的偏大.
所以答案是:(1)除去装置中的空气,防止加热时发生爆炸;(2)干燥氢气;白色粉末逐渐变蓝;(3)80%;(4)偏大
【考点精析】认真审题,首先需要了解氢气的化学性质与燃烧实验(化学性质:可燃性(用途:高能燃料;氢氧焰焊接,切割金属);还原性(用途:冶炼金属)(小结:既有可燃性,又有还原性的物质 H2、C、CO)).

练习册系列答案
 黄冈冠军课课练系列答案
黄冈冠军课课练系列答案
相关题目