题目内容
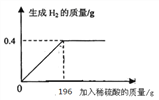
【题目】称取30.0g黄铜(铜锌合金)样品,向其中逐渐加入稀HCl,产生气体质量与加入稀HCl质量的关系如图所示。请计算:
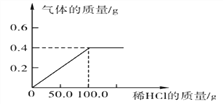
(1)样品中含铜________________________g;
(2)样品中Zn的质量分数为__________________________;
(3)稀盐酸中溶质的质量分数为____________(写出计算过程,计算结果精确到0.1%)
【答案】 17g 43.3% 14.6%
【解析】解:通过图象中的数据观察生成氢气的质量是0.4g;
设参加反应的锌的质量为x,参加反应的氯化氢为y,
Zn+2HCl=ZnCl2+H2↑
65 73 2
x y 0.4g
![]() ,
, ![]()
x=13g,y=14.6g
(1) 样品中铜的质量:30g-13g=17g,
(2) 样品中Zn的质量分数为: ![]() ×100%=43.3%;
×100%=43.3%;
(3)所以稀盐酸中溶质的质量分数为: ![]() ×100%=14.6%。
×100%=14.6%。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目