题目内容
(2008?雅安)某校化学课外活动小组的同学需要一些硫酸做化学实验.现有一瓶未开启的浓硫酸,标签如图.请阅读标签上的说明,并通过计算回答下列问题.
(1)若需要配制368.0g 19.6%的稀硫酸,应取该浓硫酸多少毫升?(计算结果保留一位小数)
(2)课外活动小组的同学实验结束后需要处理实验中产生的废碱液(溶质为NaOH,其它物质不跟硫酸反应),已知该废碱液中NaOH的质量分数为5.0%,若要中和该废碱液1000.0g,通过计算确定需要98.0%的浓硫酸多少克?(计算结果保留一位小数)

(1)若需要配制368.0g 19.6%的稀硫酸,应取该浓硫酸多少毫升?(计算结果保留一位小数)
(2)课外活动小组的同学实验结束后需要处理实验中产生的废碱液(溶质为NaOH,其它物质不跟硫酸反应),已知该废碱液中NaOH的质量分数为5.0%,若要中和该废碱液1000.0g,通过计算确定需要98.0%的浓硫酸多少克?(计算结果保留一位小数)

分析:(1)根据溶质一定,利用溶质质量分数公式即可计算出应取该浓硫酸的质量,然后根据“体积=质量÷密度”即可计算出应取该浓硫酸的体积;
(2)根据氢氧化钠与硫酸反应的化学方程式和氢氧化钠的质量,列出比例式,即可计算出需要98.0%的浓硫酸的质量.
(2)根据氢氧化钠与硫酸反应的化学方程式和氢氧化钠的质量,列出比例式,即可计算出需要98.0%的浓硫酸的质量.
解答:解:(1)368.0g×19.6%÷98.0%=73.6g,
73.6g÷1.84g∕mL=40mL;
(2)设需要98.0%的浓硫酸的质量为x,
2NaOH+H2SO4═Na2SO4+2H2O
80-----98
1000g×5%,98%x
∴80:98=(1000g×5%):98%x,
解之得:x=62.5g.
答:(1)应取该浓硫酸40毫升;
(2)需要98.0%的浓硫酸62.5g.
73.6g÷1.84g∕mL=40mL;
(2)设需要98.0%的浓硫酸的质量为x,
2NaOH+H2SO4═Na2SO4+2H2O
80-----98
1000g×5%,98%x
∴80:98=(1000g×5%):98%x,
解之得:x=62.5g.
答:(1)应取该浓硫酸40毫升;
(2)需要98.0%的浓硫酸62.5g.
点评:本题主要考查学生利用化学方程式进行计算的能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
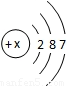 ;则x=______.根据元素原子结构示意图,不能直接获得的信息是______(填编号).
;则x=______.根据元素原子结构示意图,不能直接获得的信息是______(填编号).