题目内容
【题目】如图是甲、乙两种固体物质的溶解度曲线.下列说法正确的是( )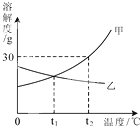
A.将t2℃时甲、乙的饱和溶液均降温到t1℃,都有晶体析出
B.t2℃时,100g甲的饱和溶液中含甲的质量为30g
C.t1℃时,甲、乙的溶解度相等
D.t2℃时,甲溶液溶质的质量分数一定大于乙溶液溶质的质量分数
【答案】C
【解析】A.根据溶解度曲线图可知,甲物质的溶解度随温度的升高而逐渐增大,故从t2℃降温至t1℃时,甲物质的溶液中会有溶质析出;但由于乙物质的溶解度随温度的升高而逐渐减小,故从t2℃降温到t1℃时,乙物质的饱和溶液会变为不饱和溶液,错误;
B.根据溶解度曲线图可知,t2℃时,甲物质的溶解度是30g,即t2℃时,每100g水中最多溶解30g甲物质而达到饱和状态,故t2℃时,100g甲的饱和溶液中含甲的质量<30g,错误;
C.根据溶解度曲线图可知,甲、乙两物质的溶解度曲线在t1℃时相交于一点,即说明此温度下,两种物质的溶解度相等,正确;
D.根据溶解度曲线图可知,t2℃时,甲物质的溶解度>乙物质的溶解度,当两物质均为饱和溶液时,根据饱和溶液的溶质质量分数=![]() ×100%,可知此时甲溶液溶质的质量分数大于乙溶液溶质的质量分数,但由于溶液是否饱和不确定,故甲溶液溶质的质量分数不一定大于乙溶液溶质的质量分数,错误.
×100%,可知此时甲溶液溶质的质量分数大于乙溶液溶质的质量分数,但由于溶液是否饱和不确定,故甲溶液溶质的质量分数不一定大于乙溶液溶质的质量分数,错误.
故选:C.
【考点精析】解答此题的关键在于理解固体溶解度曲线及其作用的相关知识,掌握1.查找指定温度时物质的溶解度,并根据溶解度判断溶解性.2.比较相同温度时(或一定温度范围内)不同物质溶解度的大小.3.比较和确定物质的溶解度受温度影响的程度,并据此确定物质结晶或混合物分离提纯的方法.4.确定溶液的状态(饱和与不饱和).

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】某化学兴趣小组取用生石灰时,发现装生石灰(CaO)的塑料试剂瓶已经膨胀破裂。他们请教老师后得知该生石灰已经变质。他们对瓶内固体的成分产生了好奇,于是他们对这瓶固体的成分展开了探究。
【提出问题】这瓶久置的生石灰的成分是什么?
(1)【猜想假设】猜想一:全部是Ca(OH)2
猜想二:是CaO和Ca(OH)2的混合物
猜想三:是Ca(OH)2和CaCO3的混合物
你还可以作出的猜想是: .
(2)【查阅资料】Ca(OH)2微溶于水,能与稀盐酸反应生成氯化钙和水。
【分析判断】该固体可能含有Ca(OH)2的原因是(用化学方程式表示)
(3)【实验探究】
实验操作 | 实验现象 | 实验结论 |
①取少量固体,倒入适量水,充分搅拌、静置 | 固体中一定不含CaO | |
②取上层清液于试管中,通入二氧化碳 | 变浑浊 | 固体中 |
③另取少量固体放入试管中, | 有气泡冒出 | 固体中一定含CaCO3 |
写出操作②中发生的化学反应方程式。
(4)【实验结论】
通过以上实验探究,得出猜想成立。
(5)【拓展迁移】
小组同学反思了生石灰干燥剂变质的原因,认识到实验室保存氧化钙应注意。
(6)【数据处理】
为测定该固体中碳酸钙的质量分数,取样品10g于烧杯中加入稀盐酸50g,恰好完全反应,反应后烧杯中物质总质量为56.7g,则该固体中碳酸钙的质量分数是多少?(写出具体的计算过程)。

