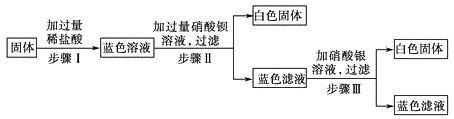
题目内容
【题目】图中A、B、C分别表示三种不同的固体物质,其溶解度曲线如图所示.请回答下列问题: 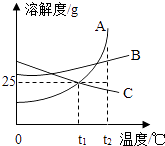
(1)这三种物质的溶液中,适用于海水晒盐原理进行结晶提纯的是 .
(2)在t2℃时,将质量均为25g的上述三种物质分别加入到100g水中,不能形成饱和溶液的是 .
(3)在t2时,将足量的三种物质的饱和溶液各蒸发10g水后再冷却到t2 , 它们析出晶体的质量分别为m(A)、m(B)和m(C),则三者的大小关系是 .
(4)将t2℃的这三种物质的饱和溶液分别降温至t1℃,所的溶液中溶质的质量分数分是ω(A)、ω(B)和ω(C),则三者的大小关系是 .
【答案】
(1)B
(2)AB
(3)m(C)<m(B)<m(A)
(4)ω(B)>ω(A)>ω(C)
【解析】解:(1)三种物质的溶解度受温度影响不大的物质是B,所以三种物质的浓溶液,适用于海水晒盐原理进行结晶的是 B;(2)t2℃时,A、B的溶解度大于25g,C的溶解度小于25g,所以,将质量均为25g的上述三种物质分别加入到100g水中,不能形成饱和溶液的是A、B;(3)t2℃,三种物质的溶解度大小关系是:C<B<A,即等量 的溶剂中溶解的物质多少关系是:C<B<A,因此将A、B、C三种物质的饱和溶液分别蒸发掉10g水,析出晶体的质量由小到大的顺序是m(C)<m(B)<m(A);(4)AB的溶解度随温度降低而减小,C的溶解度随温度降低而增大,所以将t2℃等质量A、B、C的饱和溶液降温到t1℃时,AB析出晶体,C溶质、溶剂质量不变,溶质的质量分数与降温前相等,据饱和时质量分数的计算式 ![]() ×100%,即溶解度越大质量分数也就越大,而t1℃时B的溶解度大于A的溶解度大于t2℃时C的溶解度,故溶液中溶质质量分数关系是:ω(B)>ω(A)>ω(C). 答案:(1)B;(2)AB;(3)m(C)<m(B)<m(A);(4)ω(B)>ω(A)>ω(C).
×100%,即溶解度越大质量分数也就越大,而t1℃时B的溶解度大于A的溶解度大于t2℃时C的溶解度,故溶液中溶质质量分数关系是:ω(B)>ω(A)>ω(C). 答案:(1)B;(2)AB;(3)m(C)<m(B)<m(A);(4)ω(B)>ω(A)>ω(C).
【考点精析】根据题目的已知条件,利用结晶的原理、方法及其应用和饱和溶液和不饱和溶液的相关知识可以得到问题的答案,需要掌握结晶的两种方法:蒸发溶剂,如NaCl(海水晒盐)和降低温度(冷却热的饱和溶液,如KNO3);饱和与不饱和的判断方法:看有无不溶物或继续加入该溶质,看能否溶解.

 同步练习强化拓展系列答案
同步练习强化拓展系列答案