题目内容
【题目】向盛有一定质量稀硫酸的烧杯中逐渐加入10g锌粒,产生气体质量与锌粒质量的关系如图所示;充分反应后,称得烧杯中剩余物质总质量为109.8g.请根据关系图分析并计算: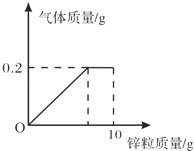
(1)稀硫酸反应完时,产生氢气的质量为g,消耗锌粒质量为g.
(2)该稀硫酸中溶质的质量分数(写出计算过程).
【答案】
(1)0.2;6.5
(2)
设锌的质量为x,稀硫酸中溶质的质量为y,
Zn+H2SO4═ZnSO4+H2↑.
65 98 2
x y 0.2g
![]() 解得:x=6.5g y=9.8g
解得:x=6.5g y=9.8g
答:该稀硫酸中溶质的质量分数: ![]() =9.8%.
=9.8%.
【解析】(1)由关系图可知,反应后生成氢气的质量为0.2g,
根据关系图分析生成的氢气的质量,由氢气的质量可求出消耗锌粒质量,参加反应的硫酸中溶质的质量,再根据溶质的质量分数计算稀硫酸中溶质的质量分数.本题主要考查了根据化学方程式的计算,难度不大,注意计算的数据要准确.

练习册系列答案
相关题目
【题目】如表是NaCl、KNO3的部分溶解度,请回答下列问题:
温度/℃ | 10 | 20 | 30 | 40 | 50 | 60 |
NaCl的溶解度/g | 35.8 | 36.0 | 36.63 | 36.6 | 37.0 | 37.3 |
KNO3的溶解度/g | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110.0 |
(1)NaCl、KNO3的溶解度受温度变化影响大的是
(2)20℃时,氯化钠的溶解度为 , 取20g氯化钠放入50g水里,充分搅拌,可得到溶液g.
(3)如图所示进行操作(每步均充分溶解),可得到饱和溶液的有(填字母),溶质质量分数最大的是(填字母)