题目内容
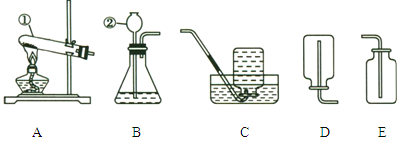
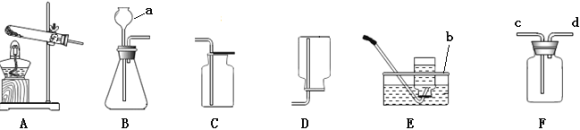
【题目】(5分)某班同学设计下图所示的实验来探究碳酸钙与盐酸反应是否遵守质量守恒定律。

(1)甲同学按图1的方案实验。称量好后,先把烧杯倾斜后又将烧杯放回托盘,看到烧杯中产生大量气泡。实验结束时天平指针将 (选填“偏左”、“偏右”、“指向中间”)
(2)乙同学认为用有气体参加或生成的反应来验证质量守恒定律时,应在密闭的体系中进行,按图2的方案实验。氢氧化钠吸收二氧化碳方程式为CO2+2NaOH=Na2CO3+H2O。调节天平平衡后,挤压胶头滴管逐滴滴入盐酸,发现天平始终保持平衡,则试管内发生反应的化学方程式为 。老师认为用该方案来验证也不合适,你认为理由是 。
(3)丙同学听从老师意见按图3的方案实验。将注射器内吸满了盐酸,全部挤入锥形瓶中,一段时间后发现天平指针突然大幅向右偏转,你认为可能原因是 。若不考虑注射器活塞自重和摩擦力作用,锥形瓶容积为750mL,注射器实际容积为12mL,吸取1mL的稀盐酸做该实验,欲确保实验成功,理论上所用盐酸的质量分数最大为 。(保留小数0.01%)(假设稀盐酸密度为1.0g/mL,二氧化碳密度为2.0g/L)
【答案】(1)偏右;(2)CaCO3+2HCl==CaCl2+H2O+CO2↑;装置内发生了两个反应,其总质量不变不能说明每个反应总质量不变;(3)产生的气体太多,瓶内气压太大导致注射器活塞弹出;3.65%
【解析】
试题分析:(1)碳酸钙和盐酸反应生成了二氧化碳气体,因此反应过程中左盘中由于气体逸出,物质质量减少,天平失去平衡,偏向右边;(2)碳酸钙和盐酸反应产生氯化钙、水和二氧化碳,反应的方程式为:CaCO3+2HCl═CaCl2+CO2↑+H2O;由于该装置内发生了两个化学反应:碳酸钙和盐酸反应,二氧化碳和氢氧化钠反应,其总质量不变不能证明每个反应前后总质量不变,因此用该方案来验证不合适;(3)由于方案将注射器内吸满了盐酸,全部挤入锥形瓶中,反应太剧烈,产生气体太多,瓶内气压太大导致注射器活塞弹出,左边质量减轻,因此一段时间后发现天平指针突然大幅向右偏转;
解:注射器实际容积为12mL,吸取1mL的稀盐酸,因此只能盛11mL的二氧化碳,即0.011L
设产生11mL的二氧化碳需要氯化氢的质量为x
CaCO3+2HCl═CaCl2+CO2↑+H2O
73 44
x 0.011L×2.0g/L
73/x=44/(0.11L×2.0g/L) x=0.0365g
因此盐酸中溶质的质量分数= 0.0365g/1mL×1.0g/mL×100%=3.65%.