题目内容
【题目】
(1)现有三组物质:①Zn、Cu、稀硫酸;②Zn、Cu、MgSO4溶液;③Zn、Cu、AgNO3溶液,用组内物质就能够比较锌和铜的金属活动性的是(填序号);
(2)相同质量的Fe和Zn分别与一定量的稀H2SO4反应,最终生成的H2质量相等,其中Zn与稀H2SO4的反应情况如下图曲线A所示。
①请用曲线B在上图中表示出Fe与稀H2SO4反应产生气体的情况。
②判断:金属(填“Zn”或“Fe”)一定有剩余。
(3)若上述反应中消耗了28g的Fe,计算由Fe产生H2的质量。(要求利用化学方程式进行计算,写出过程。)
【答案】
(1)①
(2)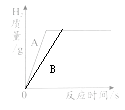 ,Fe
,Fe
(3)解:设产生氢气质量为 x
Fe+H2SO4=FeSO4+H2↑
56 2
28g x![]()
x=1g
答:由铁产生的氢气质量为1g。
【解析】(1)①Zn能与稀硫酸反应,说明锌的活动大于氢,Cu不能与稀硫酸反应,说明铜的活动性小于氢,可证明锌的活动性大于铜,正确;②Zn、Cu都不能和MgSO4溶液反应,只能证明镁的活动性最强,但无法比较锌与铜的活动性,错误;③Zn、Cu都能与AgNO3溶液反应,只能证明银的活动性最弱,无法证明锌和铜的活动性强弱,错误;(2)铁的活动性比锌弱,所以与酸反应的速率要比锌慢,因最终产生氢气质量相等,所以铁的反应过程如图所示;等质量折锌和铁反应,铁产生氢气比锌多,所以产生氢气一样多时,铁一定有剩余;
【考点精析】解答此题的关键在于理解金属活动性顺序及其应用的相关知识,掌握在金属活动性顺序里:1、金属的位置越靠前,它的活动性就越强2、位于氢前面的金属能置换出盐酸、稀硫酸中的氢(不可用浓硫酸、硝酸)3、位于前面的金属能把位于后面的金属从它们的盐溶液中置换出来.(除K、Ca、Na),以及对根据化学反应方程式的计算的理解,了解各物质间质量比=系数×相对分子质量之比.

 名校课堂系列答案
名校课堂系列答案【题目】下列方法区分各组物质,不能够达到目的是( )
待区分的物质 | 区分方法 | |
A | 高锰酸钾和氯酸钾 | 看颜色 |
B | 水和双氧水 | 分别加入二氧化锰 |
C | 二氧化碳和氮气 | 分别伸入燃着的小木条 |
D | 硬水和软水 | 分别加热煮沸 |
A.AB.BC.CD.D