题目内容
以下四种实验操作对应的曲线正确的是( )A.
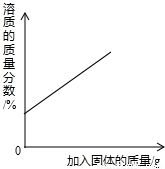
某温度下,向一定量接近饱和的硝酸钾溶液中不断加入硝酸钾晶体
B.

向硫酸铜溶液中加入过量的氢氧化钠溶液
C.

向稀盐酸中滴加过量的氢氧化钠溶液
D.
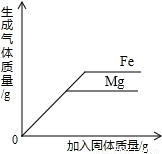
向等质量的金属镁和铁中分别加入足量且质量分数相等的稀盐酸
【答案】分析:A、某温度下,向一定量接近饱和的硝酸钾溶液中不断加入硝酸钾晶体,硝酸钾晶体继续溶解至饱和,溶液的溶质质量变大,达饱和后硝酸钾不再溶解,溶液的质量分数不再改变;
B、向硫酸铜溶液中加入过量的氢氧化钠溶液,随着氢氧化钠溶液不断增加,反应不断发生,生成氢氧化铜沉淀质量不断增加,至硫酸铜完全反应,沉淀质量不再改变;
C、向稀盐酸中滴加过量的氢氧化钠溶液,随着氢氧化钠溶液不断增加,反应不断发生,溶液的pH不断增大,至完全反应溶液pH等于7,继续加入氢氧化钠而使溶液的pH不断变大;
D、向等质量的金属镁和铁中分别加入足量且质量分数相等的稀盐酸,根据一定量金属完全反应产生氢气的质量= ×金属的质量,等质量的镁、铁完全反应放出氢气质量镁>铁.
×金属的质量,等质量的镁、铁完全反应放出氢气质量镁>铁.
解答:解:A、变化曲线表明,随着硝酸钾晶体的不断加入,溶液的质量分数不断增大;与变化事实不相符,故A不正确;
B、变化曲线表明,随着氢氧化钠溶液的加入,生成沉淀氢氧化铜的质量不断增大,至硫酸铜完全反应后,沉淀的质量不再变化;与反应事实相符,故B正确;
C、变化曲线表明,随着氢氧化钠溶液的不断加入,溶液的pH不断减小;与反应事实相反,故C不正确;
D、变化曲线表明,随着稀盐酸的不断加入,两金属放出氢气的质量不断增加,至完全反应,金属铁放出氢气质量大于金属镁;与反应事实不符,故D不正确;
故选B.
点评:分析变化图象中的曲线时,曲线的折点表示变化在此时达到最大值,这对正确分析变化具有特殊意义.
B、向硫酸铜溶液中加入过量的氢氧化钠溶液,随着氢氧化钠溶液不断增加,反应不断发生,生成氢氧化铜沉淀质量不断增加,至硫酸铜完全反应,沉淀质量不再改变;
C、向稀盐酸中滴加过量的氢氧化钠溶液,随着氢氧化钠溶液不断增加,反应不断发生,溶液的pH不断增大,至完全反应溶液pH等于7,继续加入氢氧化钠而使溶液的pH不断变大;
D、向等质量的金属镁和铁中分别加入足量且质量分数相等的稀盐酸,根据一定量金属完全反应产生氢气的质量=
 ×金属的质量,等质量的镁、铁完全反应放出氢气质量镁>铁.
×金属的质量,等质量的镁、铁完全反应放出氢气质量镁>铁.解答:解:A、变化曲线表明,随着硝酸钾晶体的不断加入,溶液的质量分数不断增大;与变化事实不相符,故A不正确;
B、变化曲线表明,随着氢氧化钠溶液的加入,生成沉淀氢氧化铜的质量不断增大,至硫酸铜完全反应后,沉淀的质量不再变化;与反应事实相符,故B正确;
C、变化曲线表明,随着氢氧化钠溶液的不断加入,溶液的pH不断减小;与反应事实相反,故C不正确;
D、变化曲线表明,随着稀盐酸的不断加入,两金属放出氢气的质量不断增加,至完全反应,金属铁放出氢气质量大于金属镁;与反应事实不符,故D不正确;
故选B.
点评:分析变化图象中的曲线时,曲线的折点表示变化在此时达到最大值,这对正确分析变化具有特殊意义.

练习册系列答案
 初中学业考试导与练系列答案
初中学业考试导与练系列答案
相关题目