题目内容
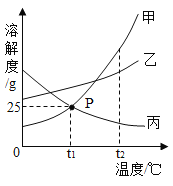
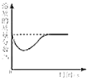
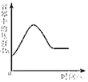
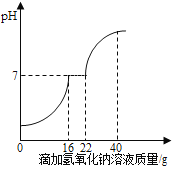
【题目】在学习酸的性质时,同学们发现实验室的工业盐酸呈黄色,老师解释说是应为里面含有氯化铁。为测定这瓶工业盐酸中氯化铁的含量(假设不含其他杂质),小霞做了如下实验:取20g工业盐酸加入到小烧杯中,然后向小烧杯中不断滴加溶质质量分数为10%的氢氧化钠溶液,同时用电子pH计不断读取反应时的pH,得出如图所示的关系。
求:
(1)与盐酸发生反应的氢氧化钠溶液的质量为 g。
(2)求该工业盐酸中氯化铁的溶质质量分数。(结果保留至0.1%)。
【答案】(1)16(2)4.1%
【解析】
当氯化铁和盐酸混合在一起时,加入氢氧化钠,由于此时溶液时酸性的,所以氢氧化钠先和盐酸反应(此时不能理解为酸碱中和优先,而是氢氧化铁在酸性环境不能生成,只能在中性或者碱性环境生成,所以判断反应时需要考虑反应发生的环境),等到盐酸被完全消耗时氢氧化钠才和氯化铁反应生成沉淀,此时溶液处于中性环境。
(1)根据图中信息可知:与盐酸反应的氢氧化钠溶液的质量为16g;
(2)根据图中信息可知:与氯化铁反应的氢氧化钠的质量= ![]() ;
;
设氯化铁的质量为x,
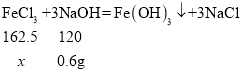
![]()
x=0.8125g,
该工业盐酸中氯化铁的质量分数=![]() ,
,
答:该工业盐酸中氯化铁的溶质质量分数为4.1%。

练习册系列答案
 走进文言文系列答案
走进文言文系列答案
相关题目
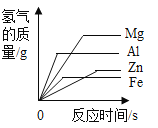
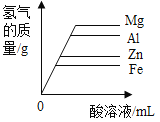
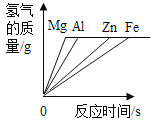
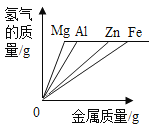
【题目】镁、铝、锌、铁与稀盐酸或稀硫酸之间的反应规律及图象正确的是( )
|
|
|
|
A等质量的镁、铝、锌、铁与足量酸反应,氢气质量与反应时间的关系图象 | B等质量的镁、铝、锌、铁与足量酸反应,氢气质量与酸溶液的关系图象 | C等量酸与足量镁、铝、锌、铁反应,氢气质量与反应时间的关系图象 | D等量酸与足量镁、铝、锌、铁反应,氢气质量与金属质量的关系图象 |
A.AB.BC.CD.D