题目内容
普通食盐的主要成份是NaCl和杂质,假设杂质不溶于水、受热不分解、与AgNO3不反应。王华同学测定普通食盐样品中氯化钠的质量分数时所进行的实验操作流程和实验数据如下图所示。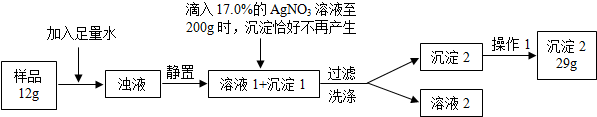
(实验中发生的化学反应方程式为:AgNO3+NaCl=AgCl↓+NaNO3)
请你完成空格和计算:
(1)王华进行操作1的目的是 _;
(2)求算样品中氯化钠的质量分数。(结果保留小数点后1位)
(1)干燥沉淀2;(2)样品中氯化钠的质量分数为97.5%
解析试题分析:(1)过滤后沉淀2表面含有水,要得到沉淀2需除去表面的水,故操作1是将沉淀2进行干燥,除去水分,所起的作用是干燥沉淀2。
(2)由题意,食盐的主要成份是NaCl,氯化钠与加入的硝酸银溶液反应生成氯化银沉淀和硝酸钠,由参加反应的硝酸银溶液的质量200g、溶质的质量分数17.0%,利用溶质质量=溶液质量×溶质的质量分数,计算出所含溶质硝酸银的质量,进而由反应的化学方程式计算出样品中氯化钠的质量及质量分数200g17.0%的硝酸银溶液中含硝酸银的质量为200g×17.0%=34.0g,由于29g不溶性物质并不都是氯化银,所以不能用于求算氯化钠。设样品中氯化钠的质量为x
AgNO3+NaCl=AgCl↓+NaNO3
170 58.5
34.0g x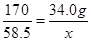
解得x=11.7g
样品中氯化钠的质量分数为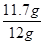 ×100%≈97.5%。
×100%≈97.5%。
答:(1)干燥沉淀2;(2)样品中氯化钠的质量分数为97.5%
考点:考查根据化学反应方程式的计算

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
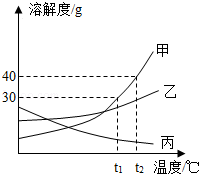
下图为NaCl、KNO3的溶解度曲线,下列说法正确的是
| A.KNO3的溶解度一定大于NaCl溶解度 |
| B.20℃时,50g水最多能溶解31.6gKNO3 |
| C.t℃时,NaCl和KNO3的饱和溶液的溶质质量分数相等 |
| D.50℃的NaCl饱和溶液降温到20℃时变成不饱和溶液 |
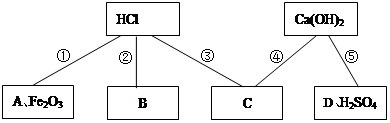


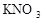 、
、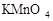 、
、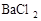 、
、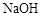 中的一种或几种。
中的一种或几种。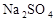 溶液,产生白色沉淀,则废液中一定还含有的物质是______________,可能含有的物质是_______________。
溶液,产生白色沉淀,则废液中一定还含有的物质是______________,可能含有的物质是_______________。