题目内容
实验室按照如图所示的装置制取二氧化碳并检验二氧化碳的性质,试回答下列问题:
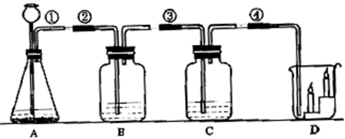
(1)实验开始前,应检查A装置的
(2)用装置A来制取CO2气体,应在A 中加入的药品是
(3)若B中盛有紫色石蕊试液,观察到的现象是
(4)若用装置C鉴定产生的二氧化碳气体,在C中盛放的试剂是
(5)烧杯D中燃着的蜡烛如图所示,D中观察到的现象为
(6)图中①装置还可以作为制取

(1)实验开始前,应检查A装置的
气密性
气密性
.(2)用装置A来制取CO2气体,应在A 中加入的药品是
大理石(或石灰石)
大理石(或石灰石)
和稀盐酸
稀盐酸
(填名称),观察到的现象是大理石(或石灰石)表面产生大量气泡
大理石(或石灰石)表面产生大量气泡
,反应的化学方程式CaCO3+2HCl═CaCl2+H2O+CO2↑
CaCO3+2HCl═CaCl2+H2O+CO2↑
.(3)若B中盛有紫色石蕊试液,观察到的现象是
紫色石蕊试液变红色
紫色石蕊试液变红色
,反应的化学方程式CO2+H2O═H2CO3
CO2+H2O═H2CO3
.(4)若用装置C鉴定产生的二氧化碳气体,在C中盛放的试剂是
澄清的石灰水
澄清的石灰水
,产生的现象是石灰水变浑浊
石灰水变浑浊
,反应的化学方程式Ca(OH)2+CO2═CaCO3↓+H2O
Ca(OH)2+CO2═CaCO3↓+H2O
.(5)烧杯D中燃着的蜡烛如图所示,D中观察到的现象为
下层蜡烛先熄灭,上层蜡烛后熄灭
下层蜡烛先熄灭,上层蜡烛后熄灭
.证明二氧化碳具有密度比空气大
密度比空气大
、不能燃烧
不能燃烧
、不支持燃烧
不支持燃烧
等性质.(6)图中①装置还可以作为制取
O2
O2
(填一种气体物质的化学式)的发生装置,化学反应方程式是2H2O2
2H2O+O2↑
| ||
2H2O2
2H2O+O2↑
.
| ||
分析:(1)凡是有气体参加或产生的实验,实验前一定要检查装置的气密性;
(2)实验室通常用大理石或石灰石和稀盐酸反应制取二氧化碳,大理石或石灰石的主要成分是碳酸钙,能和稀盐酸反应生成氯化钙、水和二氧化碳;
(2)二氧化碳能和水反应生成碳酸,碳酸显酸性,能使石蕊试液变红色;
(4)二氧化碳能和氢氧化钙反应生成碳酸钙沉淀和水,因此二氧化碳能使澄清石灰水变浑浊;
(5)二氧化碳的密度比空气大,不能燃烧,不支持燃烧,生活中可以用来灭火;
(6)A装置还可以用来制取氧气、氢气等气体,过氧化氢在二氧化锰的催化作用下,分解生成水和氧气.
(2)实验室通常用大理石或石灰石和稀盐酸反应制取二氧化碳,大理石或石灰石的主要成分是碳酸钙,能和稀盐酸反应生成氯化钙、水和二氧化碳;
(2)二氧化碳能和水反应生成碳酸,碳酸显酸性,能使石蕊试液变红色;
(4)二氧化碳能和氢氧化钙反应生成碳酸钙沉淀和水,因此二氧化碳能使澄清石灰水变浑浊;
(5)二氧化碳的密度比空气大,不能燃烧,不支持燃烧,生活中可以用来灭火;
(6)A装置还可以用来制取氧气、氢气等气体,过氧化氢在二氧化锰的催化作用下,分解生成水和氧气.
解答:解:(1)实验开始前,应检查A装置的气密性,方法为:将装置中导气管上的胶皮管用弹簧夹夹住,向长颈漏斗中注水至形成一段液柱,一段时间后若液面不下降,即可证明装置不漏气.
故填:气密性.
(2)应在A装置中加入的药品是大理石(或石灰石)和稀盐酸,大理石或石灰石的主要成分是碳酸钙,能和稀盐酸反应生成氯化钙、水和二氧化碳,反应的化学方程式为:
CaCO3+2HCl═CaCl2+H2O+CO2↑,过程中能够观察到大理石(或石灰石)表面产生大量气泡.
故填:大理石(或石灰石);稀盐酸;大理石(或石灰石)表面产生大量气泡;CaCO3+2HCl═CaCl2+H2O+CO2↑.
(3)B中盛有紫色石蕊试液,观察到的现象是紫色石蕊试液变红色,这是因为二氧化碳和石蕊试液中的水反应生成了碳酸,反应的化学方程式为:CO2+H2O═H2CO3.
故填:紫色石蕊试液变红色;CO2+H2O═H2CO3.
(4)二氧化碳能使澄清石灰水变浑浊,反应的化学方程式为:Ca(OH)2+CO2═CaCO3↓+H2O,因此若用装置C鉴定产生的二氧化碳气体,在C中盛放的试剂是澄清石灰水,产生的现象是石灰水变浑浊.
故填:澄清的石灰水;石灰水变浑浊;Ca(OH)2+CO2═CaCO3↓+H2O.
(5)因为二氧化碳的密度比空气大,不能燃烧,不支持燃烧,所以向烧杯D中通入二氧化碳时,能够观察到下层蜡烛先熄灭,上层蜡烛后熄灭.
故填:下层蜡烛先熄灭,上层蜡烛后熄灭;密度比空气大;不能燃烧;不支持燃烧.
(6)图中①装置还可以用来制取氧气,氧气的化学式是O2,过氧化氢在二氧化锰的催化作用下,分解生成水和氧气,反应的化学方程式为:2H2O2
2H2O+O2↑.
故填:O2;2H2O2
2H2O+O2↑.
故填:气密性.
(2)应在A装置中加入的药品是大理石(或石灰石)和稀盐酸,大理石或石灰石的主要成分是碳酸钙,能和稀盐酸反应生成氯化钙、水和二氧化碳,反应的化学方程式为:
CaCO3+2HCl═CaCl2+H2O+CO2↑,过程中能够观察到大理石(或石灰石)表面产生大量气泡.
故填:大理石(或石灰石);稀盐酸;大理石(或石灰石)表面产生大量气泡;CaCO3+2HCl═CaCl2+H2O+CO2↑.
(3)B中盛有紫色石蕊试液,观察到的现象是紫色石蕊试液变红色,这是因为二氧化碳和石蕊试液中的水反应生成了碳酸,反应的化学方程式为:CO2+H2O═H2CO3.
故填:紫色石蕊试液变红色;CO2+H2O═H2CO3.
(4)二氧化碳能使澄清石灰水变浑浊,反应的化学方程式为:Ca(OH)2+CO2═CaCO3↓+H2O,因此若用装置C鉴定产生的二氧化碳气体,在C中盛放的试剂是澄清石灰水,产生的现象是石灰水变浑浊.
故填:澄清的石灰水;石灰水变浑浊;Ca(OH)2+CO2═CaCO3↓+H2O.
(5)因为二氧化碳的密度比空气大,不能燃烧,不支持燃烧,所以向烧杯D中通入二氧化碳时,能够观察到下层蜡烛先熄灭,上层蜡烛后熄灭.
故填:下层蜡烛先熄灭,上层蜡烛后熄灭;密度比空气大;不能燃烧;不支持燃烧.
(6)图中①装置还可以用来制取氧气,氧气的化学式是O2,过氧化氢在二氧化锰的催化作用下,分解生成水和氧气,反应的化学方程式为:2H2O2
| ||
故填:O2;2H2O2
| ||
点评:本题主要考查了实验室制取二氧化碳的药品、实验现象、二氧化碳的性质及其化学方程式的书写的方面的知识;
书写化学方程式要注意四步:一是反应物和生成物的化学式要正确;二是要遵循质量守恒定律,即配平;三是要有必要的条件;四是看是否需要“↑”或“↓”.
书写化学方程式要注意四步:一是反应物和生成物的化学式要正确;二是要遵循质量守恒定律,即配平;三是要有必要的条件;四是看是否需要“↑”或“↓”.

练习册系列答案
相关题目
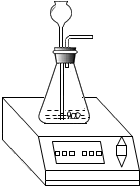 某化学兴趣小组为测定实验室中一瓶久置的过氧化氢溶液中溶质的质量分数,进行如下实验.
某化学兴趣小组为测定实验室中一瓶久置的过氧化氢溶液中溶质的质量分数,进行如下实验.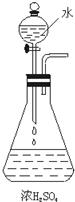 14、按照如图所示的装置,在锥形瓶中盛浓硫酸,在分液漏斗中装水.打开分液漏斗的活塞,让水滴入锥形瓶.
14、按照如图所示的装置,在锥形瓶中盛浓硫酸,在分液漏斗中装水.打开分液漏斗的活塞,让水滴入锥形瓶.