题目内容
20、有一杯主要含有MgCl2和CaCl2的硬水.某兴趣小组设计出软化水的部分实验方案,请你一起来完成.可供选用的物质有:Ca(OH)2溶液、NaOH溶液、饱和Na2CO3溶液、肥皂水.

分析:①根据氢氧化钙与氯化镁反应生成氯化钙和氢氧化镁沉淀的性质回答.
②根据氯化钙能与碳酸钠反应生成碳酸钙沉淀和氯化钠的性质回答.
③根据硬水和软水的鉴别方法回答.
②根据氯化钙能与碳酸钠反应生成碳酸钙沉淀和氯化钠的性质回答.
③根据硬水和软水的鉴别方法回答.
解答:解:要使含有硬水软化,就要除去MgCl2和CaCl2杂质.
①氢氧化钙与氯化镁反应生成氯化钙和白色的氢氧化镁沉淀,方程式为:MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2.
②因为氯化钙能与碳酸钠反应生成白色的碳酸钙沉淀和氯化钠,可使氯化钙转化成碳酸钙沉淀除去,生成的氯化钠不影响硬水的软化.
③在水样中加入肥皂水,振荡,如泡沫较多就证明是软水了.
故答案为:
①氢氧化钙与氯化镁反应生成氯化钙和白色的氢氧化镁沉淀,方程式为:MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2.
②因为氯化钙能与碳酸钠反应生成白色的碳酸钙沉淀和氯化钠,可使氯化钙转化成碳酸钙沉淀除去,生成的氯化钠不影响硬水的软化.
③在水样中加入肥皂水,振荡,如泡沫较多就证明是软水了.
故答案为:
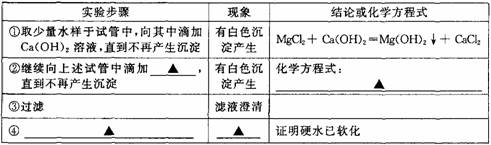
| 实验步骤 | 现象 | 结论或化学方程式 |
| ① | 化学方程式: MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2 | |
| ②继续向上述试管中滴加饱和Na2CO3溶液,直到不再产生沉淀 | ||
| ③过滤,滤液澄清,往滤液中加入少量肥皂水,振荡 |
点评:本题实际上是除杂题和硬水与软水的鉴别题,要使含有硬水软化,就要除去MgCl2和CaCl2杂质,要充分利用MgCl2、CaCl2、Ca(OH)2、NaOH、Na2CO3的化学性质,使钙、镁离子化成沉淀除去即可.

练习册系列答案
 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案
相关题目
2008年“中国水周”活动的宣传主题为“发展水利,改善民生”.
(1)①水______(填“属于”或“不属于”)六大类营养素之一.
②保持水的化学性质的最小粒子是______.
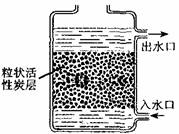
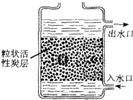
(2)如图,是活性炭净水器示意图,其中活性炭的作用是:不仅可以______的物质,还可以______的杂质.
(3)有一杯主要含有MgCl2和CaCl2的硬水.某兴趣小组设计出软化水的部分实验方案,请你一起来完成.
可供选用的物质有:Ca(OH)2溶液、NaOH溶液、饱和Na2CO3溶液、肥皂水

(1)①水______(填“属于”或“不属于”)六大类营养素之一.
②保持水的化学性质的最小粒子是______.
(2)如图,是活性炭净水器示意图,其中活性炭的作用是:不仅可以______的物质,还可以______的杂质.
(3)有一杯主要含有MgCl2和CaCl2的硬水.某兴趣小组设计出软化水的部分实验方案,请你一起来完成.
可供选用的物质有:Ca(OH)2溶液、NaOH溶液、饱和Na2CO3溶液、肥皂水
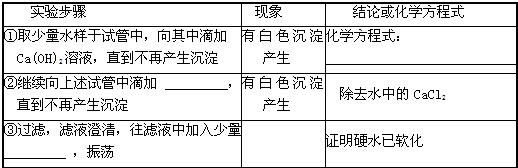
| 实验步骤 | 现象 | 结论或化学方程式 |
| ①取少量水样于试管中,向其中滴加Ca(OH)2溶液,直到不再产生沉淀 | 有白色沉淀产生 | MgCl2+Ca(OH)2=Mg(OH)2↓+CaCl2 |
| ②继续向上述试管中滴加______,直到不再产生沉淀 | 有白色沉淀产生 | 化学方程式:______ |
| ③过滤 | 滤液澄清 | |
| ④______ | ______ | 证明硬水已软化 |


 2008年“中国水周”活动的宣传主题为“发展水利,改善民生”.
2008年“中国水周”活动的宣传主题为“发展水利,改善民生”.