��Ŀ����
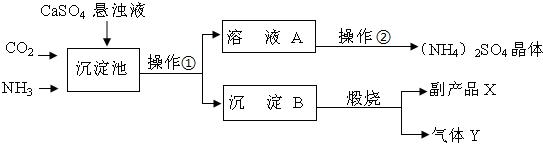
������̼�IJ�������ʵ������������ŵ���Ҫ;��֮һ����ѧ������NaOH��Һ���ܡ����������е�CO2������ͼ����

��1���������з�����Ӧ�Ļ�ѧ����ʽΪ ��������з�����Ӧ�Ļ�ѧ����ʽΪ �� ��
��2���������� ���һ��������һ���������й��ˡ����ʢ��� ��Һ��
��3��������ҵ������ ��ѡ��A��B��C���ڷ����˸��ֽⷴӦ��
A�������� B������� C�� ����¯
��4�����������п���ѭ��ʹ�õ����ʳ����ʢٵ���Һ�⣬���� ��
��5����NaOH��Һ���ܡ����������е�CO2�ĺô��� ��

��1���������з�����Ӧ�Ļ�ѧ����ʽΪ ��������з�����Ӧ�Ļ�ѧ����ʽΪ �� ��
��2���������� ���һ��������һ���������й��ˡ����ʢ��� ��Һ��
��3��������ҵ������ ��ѡ��A��B��C���ڷ����˸��ֽⷴӦ��
A�������� B������� C�� ����¯
��4�����������п���ѭ��ʹ�õ����ʳ����ʢٵ���Һ�⣬���� ��
��5����NaOH��Һ���ܡ����������е�CO2�ĺô��� ��
����1��2NaOH+CO2=Na2CO3+H2O��CaO+H2O=Ca(OH)2��Ca(OH)2+Na2CO3= CaCO3��+2NaOH����д���ܷ�Ӧʽ��CaO+H2O+Na2CO3= CaCO3��+2NaOH��ֱ�ӵ�2�֣�
��2��һ�� �������� ��3��B ��4�������� ��5��������������Һ�ĽӴ����ʣ��Ե��������ա�
��2��һ�� �������� ��3��B ��4�������� ��5��������������Һ�ĽӴ����ʣ��Ե��������ա�
�����������1������ͼʾ���������з����ķ�Ӧ�Ƕ�����̼������������Һ�ķ�Ӧ�����߷�Ӧ����̼���ƺ�ˮ���ʷ�Ӧ�Ļ�ѧ����ʽΪ2NaOH+CO2=Na2CO3+H2O����������з����ķ�Ӧ�������������ƺ�ˮ��Ӧ�����������ƣ��ʷ�Ӧ�Ļ�ѧ����ʽΪCaO+H2O=Ca(OH)2��Ȼ�������ɵ��������ƺ�̼������Һ��Ӧ����̼��Ƴ������������ƣ��ʷ�Ӧ�Ļ�ѧ����ʽΪCa(OH)2+Na2CO3= CaCO3��+2NaOH��
��2������ͼʾ��֪���������ǽ�̼��Ƴ����ӷ�����з�������IJ������ʲ������к��й��˲������ٸ�������ķ�����֪�������������������̼��Ƴ���������������Һ�������������ǽ�̼��Ƴ���������������¯���ʽ��������������ʢ���ʣ�������������Һ��
��3����������ķ�����֪���������з����ķ�Ӧ�Ƕ�����̼������������Һ�ķ�Ӧ���÷�Ӧ�е�����Ӧ��û�гɷֵĽ������ʲ����ڸ��ֽⷴӦ����������з������������ƺ�̼������Һ�ķ�Ӧ�������ֻ�����������ɷ������������ֻ�����ķ�Ӧ�������ڸ��ֽⷴӦ������¯�еķ�Ӧ��̼����ڸ����·ֽ⣬���������ƺͶ�����̼���ʴ˷�Ӧ�ǷֽⷴӦ����ѡB
��4������ͼʾ��֪�������������У�ѭ�����õ���������ʯ�Һ�����������Һ��
��5������ͼʾ����NaOH��Һ���ܡ����������е�CO2������NaOH��Һ�����״�����������̼��Ӧ����������������Һ��ĽӴ������ʹ��Ӧ����֡�
���������⿼���֪ʶ��϶࣬Ҫ��ѧ��Ҫ���ۺ�Ӧ�ã������Ĺؼ����������ճ���������Լ�����������ʺͻ�ѧ����ʽ����д�ȷ����֪ʶ��ֻ������������ȷ�������

��ϰ��ϵ�д�
�����Ŀ
 ����ʾ���ʼ����ת����ϵ�����ַ�Ӧ��������Ӧ��������ȥ��
����ʾ���ʼ����ת����ϵ�����ַ�Ӧ��������Ӧ��������ȥ��