题目内容
将表面被氧化为Na2O的钠块投入水中,完全反应后得到H20.2g和浓度为12%的溶液100g,则被氧化的钠的质量为
- A.1.15g
- B.2.3g
- C.3.1g
- D.4.6g
C
分析:根据钠和水反应生成氢氧化钠与氢气的化学方程式,找到题给的已知量氢气的质量和该反应生成的氢氧化钠的质量,求得参加反应的钠的质量,再依据氧化钠和水反应生成氢氧化钠,利用溶液中氢氧化钠的质量算出被氧化的钠的质量.
解答:设产生0.2g氢气需生成的氢氧化钠的质量为x
2Na+2H2O=2NaOH+H2↑
80 2
x 0.2g
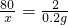
x=8g
反应后溶液中氢氧化钠的质量是100g×12%=12g,所以氧化钠和水反应生成氢氧化钠的质量是12g-8g=4g
设原有氧化钠的质量是y
Na2O+H2O=2NaOH
62 80
y 4g
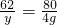
y=3.1g
故选C
点评:本题主要考查了钠、氧化钠的性质,反应较复杂,但只要理清关系即可完成.
分析:根据钠和水反应生成氢氧化钠与氢气的化学方程式,找到题给的已知量氢气的质量和该反应生成的氢氧化钠的质量,求得参加反应的钠的质量,再依据氧化钠和水反应生成氢氧化钠,利用溶液中氢氧化钠的质量算出被氧化的钠的质量.
解答:设产生0.2g氢气需生成的氢氧化钠的质量为x
2Na+2H2O=2NaOH+H2↑
80 2
x 0.2g
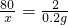
x=8g
反应后溶液中氢氧化钠的质量是100g×12%=12g,所以氧化钠和水反应生成氢氧化钠的质量是12g-8g=4g
设原有氧化钠的质量是y
Na2O+H2O=2NaOH
62 80
y 4g
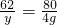
y=3.1g
故选C
点评:本题主要考查了钠、氧化钠的性质,反应较复杂,但只要理清关系即可完成.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目