题目内容
【题目】在实验考试前夕,小东同学在实验操作练习中,发现用完全相同的两份稀盐酸和相同质量的大块大理石、小块大理石分别反应,大块的反应速率要慢,原因是什么? _________ .
小东又发现盛放氢氧化钠的试剂瓶口有白色粉末.为了确定白色粉末的成分,他进行了如下的探究:
(1)小毛猜测白色粉末中含有碳酸钠,请指出他的理由: _________ (用化学方程式表示).
(2)为了确定自己的猜测,小东设计了如下的方案:取少量白色粉末于试管中,加水溶解配成溶液,再用 _________ 检验,看到溶液中有 _________ 产生,从而使自己的猜想得到了证实.
(3)玻璃中的SiO2可以和氢氧化钠发生类似的CO2的反应,则SiO2与氢氧化钠反应生成盐的化学式为 _________ .
(4)为了进一步确定白色粉末中碳酸钠的质量分数,小东取了2g白色粉末,加入足量的水充分溶解,再滴加澄清石灰水,充分反应后,过滤,得到了白色沉淀1g.
①在过滤时,需用到玻璃棒,它的作用是 _________ ;
②请你帮小东计算:白色粉末中碳酸钠的质量分数.
【答案】当稀盐酸的浓度相同时,反应物的接触面积越大,反应速率越快
(1)CO2+2NaOH=Na2CO3+H2O
(2)稀盐酸或澄清石灰水 气泡或有白色沉淀生成 (3)Na2SiO3
(4)①引流 ②53%
【解析】
试题分析:影响化学反应速率的因素有很多,比如:稀盐酸的浓度,反应温度,反应物的接触面积等,用完全相同的两份稀盐酸和相同质量的大块大理石、小块大理石分别反应,大块的反应速率要慢,原因是:当稀盐酸的浓度相同时,反应物的接触面积越大,反应速率越快
(1)氢氧化钠潮解后会与空气中的二氧化碳反应生成碳酸钠和水,反应化学方程式为:CO2+2NaOH=Na2CO3+H2O
(2)因为碳酸钠会与稀盐酸反应生成二氧化碳气体,因此可以加稀盐酸,看能否产生气泡或加石灰水看能否产生白色沉淀
(3)氢氧化钠能与二氧化碳发生化学反应,生成碳酸钠,SiO2和CO2的化学性质相似,所以SiO2与氢氧化钠反应生成硅酸钠,化学式为:Na2SiO3
(4)①过滤时玻璃棒的作用是引流,防止液体外溅,作用是:引流;
②根据化学反应:Na2CO3+Ca(OH)2=CaCO3↓+2NaOH,可知得到的白色沉淀1g即碳酸钙的质量,在根据反应中Na2CO3和CaCO3的质量关系,即可求出Na2CO3的质量,进一步可算出白色粉末中碳酸钠的质量分数
解:设白色粉末中碳酸钠的质量为X.
Na2CO3+Ca(OH)2=CaCO3↓+2NaOH
106 100
x 1g
![]() =
=![]() x=1.06g
x=1.06g
因此![]() ×100%═53%
×100%═53%
答:白色粉末中碳酸钠的质量分数为53%

 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案 明天教育课时特训系列答案
明天教育课时特训系列答案 浙江新课程三维目标测评课时特训系列答案
浙江新课程三维目标测评课时特训系列答案【题目】某同学为研究氢氧化钠溶液与稀盐酸是否恰好中和时,取少量反应后的溶液于试管中,分别用不同试剂进行实验.下列实验方法及结论错误的是( )。
实验序号 | 所用试剂 | 现象及结论 |
A | 酚酞溶液 | 溶液为无色,一定恰好中和 |
B | pH试纸 | 测得PH>7,则氢氧化钠溶液过量 |
C | 铁粉 | 有气泡产生,则稀盐酸过量 |
D | 氯化铜溶液 | 没有蓝色沉淀,一定恰好中和 |
A. A B. B C. C D. D
【题目】鉴别碳酸钠溶液和氢氧化钠溶液的实验结束后,小红同学将①、②两支试管中的废液倒入同一个干净的烧杯中,看到烧杯内的废液变浑浊,过滤后,小红等几位同学对滤液的成分又进行了探究。
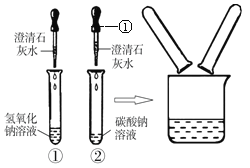
(1)指出有标号仪器的名称:_______。
(2)实验探究:
【猜想】 小红认为:只含氢氧化钠;
小明认为:
含有氢氧化钠、碳酸钠和氢氧化钙;
小亮认为:含有氢氧化钠和碳酸钠;
还有可能是 (你的猜想)。
【讨论】①三位同学的猜想,你认为是否有不合理,理由是 。 。
②小红的猜想是滤液中只含氢氧化钠,他的这种猜想的推测思路是:
。
【实验设计】设计一个简单的实验证明你的猜想正确。
实验步骤 | 实验现象 | 实验结论 |
取样于试管中, | 你的猜想正确 |
【实验分析】小亮同学针对自己的猜想进行了如下实验:
实验步骤 | 实验现象 | 实验结论 |
取样于试管中,滴入几滴稀盐酸 | 没有气泡产生 | 自己的猜想不成立 |
请你分析一下小亮同学验证自己的猜想所得出的实验结论是否正确: ,
原因是: 。