题目内容
实验室我们常用石灰石与稀盐酸反应来制取二氧化碳气体.现有足量的碳酸钙质量分数为80%的石灰石和稀盐酸,若要制66克的二氧化碳至少需这种石灰石多少克?
【答案】分析:可根据二氧化碳的质量,利用化学方程式,求出碳酸钙和二氧化碳的质量比,列出比例式进行求解碳酸钙的质量,然后利用质量分数求出石灰石的质量.
解答:解:设参加反应的碳酸钙的质量为x
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 66g

解之得:x=150g
所以石灰石的质量=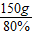 =187.5g
=187.5g
答:参加反应的石灰石的质量为187.5克
点评:本题是考查学生利用化学方程式进行简单计算的能力,思路比较简单,解题得分的关键是步骤必须规范.解题细节如下:
在利用反应的化学方程式进行计算时,首先要正确书写化学方程式,正确书写化学方程式要遵循两个原则:以客观事实为基础,遵守质量守恒定律;此外,还要注意:解、设、答要完整,已知物质与未知物质的质量关系及比例式要正确写出,计算过程中要带单位进行,设未知物质量时不需要单位等.
解答:解:设参加反应的碳酸钙的质量为x
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 66g

解之得:x=150g
所以石灰石的质量=
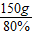 =187.5g
=187.5g答:参加反应的石灰石的质量为187.5克
点评:本题是考查学生利用化学方程式进行简单计算的能力,思路比较简单,解题得分的关键是步骤必须规范.解题细节如下:
在利用反应的化学方程式进行计算时,首先要正确书写化学方程式,正确书写化学方程式要遵循两个原则:以客观事实为基础,遵守质量守恒定律;此外,还要注意:解、设、答要完整,已知物质与未知物质的质量关系及比例式要正确写出,计算过程中要带单位进行,设未知物质量时不需要单位等.

练习册系列答案
相关题目