题目内容
【题目】实验室中瓶装浓硫酸的商标如图所示。

请根据相关信息计算:
(1)该瓶硫酸溶液的质量是____g;
(2)欲配制200g溶质质量分数为19.6%的稀硫酸,需这种浓硫酸_________mL(计算结果精确至0.1mL);
(3)写出该瓶浓硫酸中氢元素质量的计算式______________________。
【答案】 920 21.7 500mL×1.84g/mL×98%×![]() + 500mL×1.84g/mL×2%×
+ 500mL×1.84g/mL×2%×![]()
【解析】(1)由标签可读取该瓶浓硫酸的体积500mL、密度1.84g/cm3,利用m=ρV可计算该瓶浓硫酸的质量;
(2)用98%的浓硫酸配制19.6%的稀硫酸需要加水进行稀释,根据稀释前后溶液中硫酸质量不变,由稀释前浓硫酸的质量计算可配制的稀硫酸的质量.
(3)根据化学式中某元素的质量计算方法计算。
解:(1)由标签可知该瓶浓硫酸的体积500mL、密度1.84g/cm3,启封前该瓶浓硫酸溶液的质量=500mL×1.84g/cm3=920g;
(2)可配制成19.6%的稀硫酸的质量=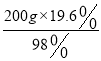 ÷1.84g/cm3 = 21.7 cm3,约是21.7 mL;
÷1.84g/cm3 = 21.7 cm3,约是21.7 mL;
(3)该瓶浓硫酸中氢元素质量包括浓硫酸中的氢元素和溶剂水中的氢元素。故写出该瓶浓硫酸中氢元素质量的计算式:500mL×1.84g/mL×98%×![]() + 500mL×1.84g/mL×2%×
+ 500mL×1.84g/mL×2%×![]() 。
。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目