题目内容
【题目】归纳总结是学习化学的重要方法,某化学兴趣小组学习碱的性质后,通过实验对氢氧化钙的化学性质进行了验证和总结,如图所示“____”表示物质之间能发生化学反应。请回答问题:

(1)甲同学将酚酞试液滴入氢氧化钙溶液中,观察到溶液变红,得出结论:氢氧化钙溶液呈_____性。乙同学将过量的稀盐酸加入到甲同学所得溶液中,此时所得溶液中含有的溶质有_________
(2)丙同学将碳酸钠溶液加入氢氧化钙溶液中,充分反应后,与乙同学所得溶液混合,静置后发现:上层为无色透明的溶液,底部有白色沉淀,则上层溶液中一定含有的溶质是__________(酸碱指示剂除外),可能含有的溶质是________,为验证可能含有的溶质,可加入试剂_____。
【答案】 碱 CaCl2 和HCl NaCl CaCl2 Na2CO3溶液
【解析】(1)酚酞溶液遇酸性溶液不变色,遇碱性溶液变红色,甲同学将酚酞试液滴入氢氧化钙溶液中,观察到溶液变红,说明氢氧化钙溶液呈碱性;乙同学将过量的稀盐酸加入到甲同学所得溶液中,稀盐酸与氢氧化钙反应生成氯化钙和水,由于稀盐酸过量,最终溶液显酸性,观察到的现象是溶液红色褪去;此时所得溶液中含有的溶质有氯化钙、氯化氢(CaCl2 和HCl);(2)丙同学将碳酸钠溶液加入氢氧化钙溶液中,碳酸钠与氢氧化钙反应生成碳酸钙沉淀和氢氧化钠,与乙同学所得溶液混合,稀盐酸能与氢氧化钠、碳酸钠、碳酸钙等反应,碳酸钠与氯化钙溶液反应生成碳酸钙沉淀和氯化钠;由静置后发现:上层为无色透明的溶液,说明不含碱性物质,即不含氢氧化钠、碳酸钠;底部有白色沉淀,说明稀盐酸没有剩余,否则不会生成白色沉淀,氯化钙不能确定;故上层溶液中一定含有的溶质是氯化钠(NaCl),可能含有的溶质是氯化钙(CaCl2);为验证可能含有的溶质,可采用取上层清夜与试管中,滴加碳酸钠(Na2CO3)溶液,若产生白色沉淀,说明含有氯化钙。

 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案【题目】密闭容器内有四种物质,在一定条件下充分反应,测得反应前后各物质的质量如下表所示。下列说法正确的是![]()
物质 | 甲 | 乙 | 丙 | 丁 |
反应前质量(克) | 50 | 11 | 15 | 32 |
反应后质量(克) | 64 | M | 5 | 28 |
A. 该反应是化合反应
B. M的值是15
C. 乙一定是催化剂
D. 反应中甲、丁质量比为16 :7
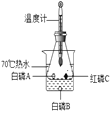
【题目】某同学对CaH2的制备和性质进行探究。
【阅读资料】①用H2与钙加热制得CaH2 ②钙遇水立即发生剧烈反应生成一种碱和一种气体 ③CaH2要密封保存,遇水反应也生成一种碱和一种气体
【CaH2的制备】设计的制取装置如图所示.
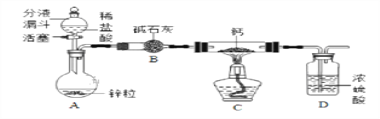
(1)装置B的作用是____________________________;
(2)制备CaH2实验结束后,取少量产物,小心加入水中,观察有气泡产生,在溶液中滴入石蕊试液后显__________色。该同学据此判断:实验中确有氢化钙生成,其他同学提出结论不一定正确,原因是________________________。
【CaH2的性质探究】取少量上述制得的CaH2 样品加入到足量的碳酸钠溶液中,产生大量气泡,过滤,得到滤渣和滤液。经检验滤渣的成分是碳酸钙。该同学进行了如下的探究。
(3)点燃产生的气体,火焰淡蓝色;将燃烧产物通入澄清石灰水中,无现象。则该气体为_________(写化学式)。
(4)对滤液中溶质的成分做出如下猜测并进行实验:
猜想一:NaOH猜想二:NaOH、Ca(OH)2 猜想三:NaOH、Na2CO3 猜想四:NaOH、Na2CO3、Ca(OH)2
经过讨论,大家一致认为猜想四不合理,请用化学方程式说明原因___________________
【实验验证】
实验 | 现象 | 结论 |
实验一:取滤液,向其中滴入少量 Na2CO3溶液 | ____________ | 猜想二不成立 |
实验二:另取滤液,向其中加入足量稀盐酸 | ________________ | 猜想三成立 |
【定量分析】
取制得的CaH2样品1g(杂质为未反应完的Ca)加入到足量的Na2CO3溶液中,充分反应后,过滤、洗涤、干燥称得CaCO3质量为2.4g,则该样品中CaH2的质量分数为__________(写出计算过程).