题目内容
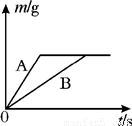
将等质量的镁粉和铝粉,分别放入质量相等、浓度相同的稀硫酸中,生成H2质量(m)随反应时间的关系如图所示.请回答下列问题:(1)写出A曲线的化学方程式 ;
(2)对于该图象的理解,下列说法正确的是 (填序号);
①反应结束后两种金属一定都有剩余 ②反应结束后一定镁粉有剩余
③反应结束后所得溶液质量相等 ④反应结束后稀硫酸都没有剩余
⑤反应结束后消耗两种金属的质量相等
(3)若将一定质量的镁粉和铝粉,同时放入一定浓度的硫酸铜溶液中,充分反应后,溶液中一定有的金属阳离子是 (填离子符号);若过滤后,向滤渣中加入稀硫酸,有气泡产生,则滤渣中一定有 (填化学式).
【答案】分析:(1)根据反应的速度判断A代表的是何种金属反应的图象并书写方程式;
(2)由已知:“等质量的镁粉和铝粉,分别放入质量相等、溶质质量分数相同的稀硫酸充分反应”:利用等质量的镁粉和铝粉如果全部反应生成氢气的量是铝大于镁,而后再利用图象的信息可知两者反应后生成的氢气质量相等分析判断;
(3)根据金属与盐溶液反应的优先置换原则以及金属与酸反应的条件分析解答即可;
解答:解:由图象可知A的反应速度大于B的反应速度,则可知A的活动性比B强,由金属活动性顺序可知镁的活动性比铝强,所以A曲线的化学方程式Mg+H2SO4=MgSO4+H2↑;
(2)依据金属与酸反应生成氢气的质量=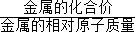 ×金属的质量可知同质量的镁与铝完全反应时铝生成的氢气质量大,故⑤错误;而图象反应两者最终生成的氢气质量相等,则反应时铝必有剩余镁是否有剩余则无法判断,故①②错误;由于反应后生成的氢气质量相等所以消耗的硫酸质量一定相等,而铝有剩余,故两者反应时酸均无剩余,故④正确;依据质量守恒定律,反应后溶液的质量=反应前的总质量-气体的质量-不溶物的质量,图示中生成氢气的质量相等,但剩余的不溶物的质量不同,所以反应结束后所得溶液质量不相等.故③错误;
×金属的质量可知同质量的镁与铝完全反应时铝生成的氢气质量大,故⑤错误;而图象反应两者最终生成的氢气质量相等,则反应时铝必有剩余镁是否有剩余则无法判断,故①②错误;由于反应后生成的氢气质量相等所以消耗的硫酸质量一定相等,而铝有剩余,故两者反应时酸均无剩余,故④正确;依据质量守恒定律,反应后溶液的质量=反应前的总质量-气体的质量-不溶物的质量,图示中生成氢气的质量相等,但剩余的不溶物的质量不同,所以反应结束后所得溶液质量不相等.故③错误;
(3)由于镁铝铜的金属活动性顺序是镁>铝>铜,所以反应时镁先要置换出硫酸铜中的铜,故溶液中一定含有镁离子,由于铜不能与稀硫酸反应制得氢气,所以,向滤渣中加入稀硫酸,有气泡产生,说明滤渣中一定含有置换出的铜和一定有剩余的铝;
故答案为:(1)Mg+H2SO4=MgSO4+H2↑;(2)④;(3)Mg2+;Cu、Al;
点评:本题考查了金属活动性顺序的应用,完成此题,可以依据金属活动性顺序及其意义进行.
(2)由已知:“等质量的镁粉和铝粉,分别放入质量相等、溶质质量分数相同的稀硫酸充分反应”:利用等质量的镁粉和铝粉如果全部反应生成氢气的量是铝大于镁,而后再利用图象的信息可知两者反应后生成的氢气质量相等分析判断;
(3)根据金属与盐溶液反应的优先置换原则以及金属与酸反应的条件分析解答即可;
解答:解:由图象可知A的反应速度大于B的反应速度,则可知A的活动性比B强,由金属活动性顺序可知镁的活动性比铝强,所以A曲线的化学方程式Mg+H2SO4=MgSO4+H2↑;
(2)依据金属与酸反应生成氢气的质量=
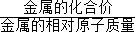 ×金属的质量可知同质量的镁与铝完全反应时铝生成的氢气质量大,故⑤错误;而图象反应两者最终生成的氢气质量相等,则反应时铝必有剩余镁是否有剩余则无法判断,故①②错误;由于反应后生成的氢气质量相等所以消耗的硫酸质量一定相等,而铝有剩余,故两者反应时酸均无剩余,故④正确;依据质量守恒定律,反应后溶液的质量=反应前的总质量-气体的质量-不溶物的质量,图示中生成氢气的质量相等,但剩余的不溶物的质量不同,所以反应结束后所得溶液质量不相等.故③错误;
×金属的质量可知同质量的镁与铝完全反应时铝生成的氢气质量大,故⑤错误;而图象反应两者最终生成的氢气质量相等,则反应时铝必有剩余镁是否有剩余则无法判断,故①②错误;由于反应后生成的氢气质量相等所以消耗的硫酸质量一定相等,而铝有剩余,故两者反应时酸均无剩余,故④正确;依据质量守恒定律,反应后溶液的质量=反应前的总质量-气体的质量-不溶物的质量,图示中生成氢气的质量相等,但剩余的不溶物的质量不同,所以反应结束后所得溶液质量不相等.故③错误;(3)由于镁铝铜的金属活动性顺序是镁>铝>铜,所以反应时镁先要置换出硫酸铜中的铜,故溶液中一定含有镁离子,由于铜不能与稀硫酸反应制得氢气,所以,向滤渣中加入稀硫酸,有气泡产生,说明滤渣中一定含有置换出的铜和一定有剩余的铝;
故答案为:(1)Mg+H2SO4=MgSO4+H2↑;(2)④;(3)Mg2+;Cu、Al;
点评:本题考查了金属活动性顺序的应用,完成此题,可以依据金属活动性顺序及其意义进行.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
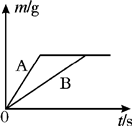 将等质量的镁粉和铝粉,分别放入质量相等、浓度相同的稀硫酸中,生成H2质量(m)随反应时间的关系如图所示.请回答下列问题:
将等质量的镁粉和铝粉,分别放入质量相等、浓度相同的稀硫酸中,生成H2质量(m)随反应时间的关系如图所示.请回答下列问题: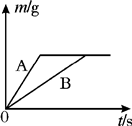 将等质量的镁粉和铝粉,分别放入质量相等、浓度相同的稀硫酸中,生成H2质量(m)随反应时间的关系如图所示.请回答下列问题:
将等质量的镁粉和铝粉,分别放入质量相等、浓度相同的稀硫酸中,生成H2质量(m)随反应时间的关系如图所示.请回答下列问题:
