题目内容
【题目】称取氯化钠和氯化钡的固体混合物32.5克,加入82.8克蒸馏水,完全溶解后向该混合溶液中逐滴加入质量分数为10%的硫酸钠溶液,反应生成沉淀的质量与所加入的硫酸钠溶液的质量关系如图所示,试回答下列问题 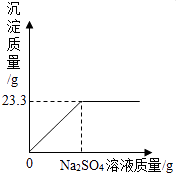
(1)完全反应后生成沉淀克.
(2)恰好完全反应时消耗硫酸钠溶液的质量是多少克?
(3)恰好完全反应时所得溶液中溶质的质量分数是多少?
【答案】
(1)23.3
(2)解:设BaCl2的质量为x,反应生成的NaCl的质量为y;恰好完全反应时消耗Na2SO4的质量为z
BaCl2+ | Na2SO4═ | BaSO4↓+ | 2NaCl |
208 | 142 | 233 | 117 |
x | z | 23.3g | y |
![]()
x=20.8g,y=11.7g,z=14.2g
恰好完全反应时消耗Na2SO4溶液的质量为:14.2g÷10%=142g
(3)解:恰好完全反应时,溶液中NaCl的质量为:11.7g+(32.5g﹣20.8g)=23.4g
恰好完全反应时所得NaCl 溶液溶质的质量分数 ![]() ×100%=10%
×100%=10%
【解析】解:(1)从图中可明显看出生成23.3g沉淀后质量不再增加,故完全反应后生成BaSO4沉淀的质量为23.3g; 所以答案是:23.3;
【考点精析】根据题目的已知条件,利用根据化学反应方程式的计算的相关知识可以得到问题的答案,需要掌握各物质间质量比=系数×相对分子质量之比.

练习册系列答案
相关题目