题目内容
【题目】 200g稀硫酸与13g锌恰好完全反应,反应后所得溶液的质量是多少?
【答案】212.6g
【解析】
试题分析:设生成氢气的质量为X
Zn + H2SO4 === ZnSO4 + H2↑
65 2
13g X
65/13g=2/x
X=0.4g
反应后所得溶液的质量根据质量守恒定律可知,200g+ 13g -0.4g=212.6g。

练习册系列答案
相关题目
【题目】为探究影响双氧水分解速度的某种因素,记录了如下实验数据:
双氧水的质量 | 双氧水的浓度 | MnO2的质量 | 相同时间内产生O2的体积 | |
Ⅰ | 50.0g | 1% | 0.1g | 9mL |
Ⅱ | 50.0g | 2% | 0.1g | 16mL |
Ⅲ | 50.0g | 4% | 0.1g | 31mL |
【数据处理及结论】
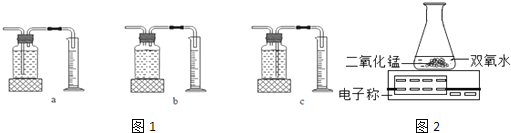
(1)本实验中,测量O2体积的装置是 (选填图1中的装置编号).
(2)实验结论:在相同条件下, ,双氧水分解速率越快.
(3)C小组用如图2装置进行实验,通过比较 也能达到实验目的.