题目内容
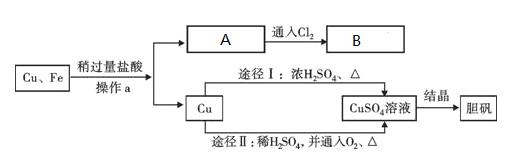
【题目】为了除去铜粉中混有的铁粉,并用提纯的铜粉制取胆矾(CuSO45H2O),某课外活动小组的同学按如下流程进行实验(反应中部分生成物已略去)。
已知:Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O。
CuSO4+SO2↑+2H2O。
回答下列有关问题:
(1)操作a的名称是__;除去铜粉中的铁粉,最简便的实验方法是__.
(2)A溶液的溶质为____________,A到B的反应中,溶液最终变为黄色,发生了化合反应,则反应的方程式为_____________________
(3)由Cu制CuSO4溶液的途径Ⅱ中,反应的方程式为____________(产物为硫酸铜和一种液体)。途径Ⅱ与途径Ⅰ相比较,其显著的优点是_____(回答一点即可).
(4)硫酸铜溶液如何转化为胆矾:浓缩和_______________(蒸发结晶或降温结晶) 。
【答案】 过滤 用磁铁吸引 FeCl2溶液 2FeCl2+Cl2=2FeCl3 2Cu+2H2SO4+ O2![]() 2CuSO4+2H2O 不会产生污染空气的二氧化硫气体 降温结晶
2CuSO4+2H2O 不会产生污染空气的二氧化硫气体 降温结晶
【解析】(1)操作a是用来分离固体与液体的方法,是过滤;铁可以被磁铁吸引,而铜不会,所以可用磁铁吸引的方法除去铜粉中混有的铁粉;
(2)铜不与盐酸反应,铁与盐酸反应生成氯化亚铁和氢气,所以A溶液的溶质为:氯化亚铁溶液;氯化亚铁与氯气反应生成氯化铁;化学方程式为:2FeCl2+Cl2=2FeCl3;
(3)在金属活动顺序中,铜排在H后面,与硫酸不反应;铜和硫酸在氧气作用下生成硫酸铜和水,化学方程式为:2Cu+2H2SO4+ O2![]() 2CuSO4+2H2O;
2CuSO4+2H2O;
铜与浓硫酸的反应中会产生有毒的二氧化硫气体而污染空气;
(4)硫酸铜溶液中获得硫酸铜晶体,实验步骤为:蒸发浓缩、降温结晶、过滤、洗涤、干燥等。

练习册系列答案
相关题目