题目内容
【题目】为了测定某含杂质的赤铁矿样品中氧化铁的含量(杂质不溶于水,不与其它物质 反应),某化学小组进了如下实验: 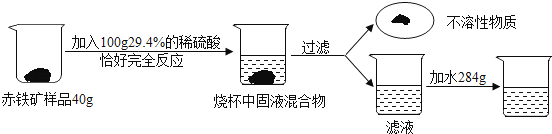
(1)若用质量分数98%的浓硫酸配制上述实验所用稀硫酸,所加水的质量是;
(2)发生反应的化学方程式为
(3)根据己知条件列出求解40g该赤铁矿样品中氧化铁的质量(X)的化例式;
(4)该赤铁矿中氧化铁的含量为
(5)向所得滤液中加入284g氷,则最终所得滤液中溶质的质量分数为;
(6)现用500t此种赤铁矿石炼制生铁,冶炼过程中损失铁元素10%,则最终可炼得含铁90%的生铁的质量为 .
【答案】
(1)30g
(2)Fe2O3+3H2SO4═Fe2(SO4)3+3H2O
(3)
![]()
(4)40%
(5)10%
(6)140t
【解析】解:(1)设加入水的质量为x,
根据题意有:x×98%=100g×29.4%,
x=30g,
故填:30g.
2)氧化铁和稀硫酸反应的化学方程式为:Fe2O3+3H2SO4═Fe2(SO4)3+3H2O.
故填:Fe2O3+3H2SO4═Fe2(SO4)3+3H2O.
3)设氧化铁质量为X,生成硫酸铁质量为z,
Fe2O3+3H2SO4═Fe2(SO4)3+3H2O,
160 294 400
y 100g×29.4% z![]() =
= ![]() =
= ![]() ,
,
X=16g,z=40g,
求解40g该赤铁矿样品中氧化铁的质量(X)的化例式为: ![]()
4)该赤铁矿中氧化铁的含量为: ![]() ×100%=40%.
×100%=40%.
故填:40%.
5)则最终所得滤液中溶质的质量分数为: ![]() ×100%=10%,
×100%=10%,
故填:10%.
6)则最终可炼得含铁90%的生铁的质量为:500t×40%× ![]() ×100%×(1﹣10%)÷90%=140t,
×100%×(1﹣10%)÷90%=140t,
故填:140t.
【考点精析】利用根据化学反应方程式的计算对题目进行判断即可得到答案,需要熟知各物质间质量比=系数×相对分子质量之比.

 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案