题目内容
工业上用煅烧石灰石的方法制取CO2,今欲制取2240LCO2(已知CO2的密度为1.97/L),若用含杂质20%的石灰石来制取,需要这种石灰石多少千克?______.
【答案】分析:根据锻烧石灰石反应的化学方程式,可判断反应中生成二氧化碳与锻烧碳酸钙的质量关系,因此把欲制取二氧化碳的体积转换为质量后,利用反应的化学方程式计算碳酸钙的质量,即可求得需要这种石灰石的质量.
解答:解:CO2的质量为2240L×1.97g/L=4412.8g≈4.4Kg
设需石灰石的质量为x
CaCO3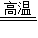 CaO+CO2↑
CaO+CO2↑
100 44
x×(1-20%) 4.4Kg
 =
=
x=12.5Kg
故答案为:12.5Kg.
点评:此为基础的化学方程式的计算,计算过程需要注意石灰石中含杂质为20%而含碳酸钙则应为1-20%=80%.
解答:解:CO2的质量为2240L×1.97g/L=4412.8g≈4.4Kg
设需石灰石的质量为x
CaCO3
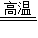 CaO+CO2↑
CaO+CO2↑100 44
x×(1-20%) 4.4Kg
 =
=
x=12.5Kg
故答案为:12.5Kg.
点评:此为基础的化学方程式的计算,计算过程需要注意石灰石中含杂质为20%而含碳酸钙则应为1-20%=80%.

练习册系列答案
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案
相关题目
下列化学方程式符合题意且书写正确的是( )
| A、正常雨水的pH为5.6的原因CO2+H2O═H2CO3 | B、用盐酸除去铁器表面的铁锈FeO+2HCl═FeCl2+H2O | C、工业上用煅烧石灰石的方法制生石灰CaCO3═CaO+CO2 | D、证明铁的金属活动性比氢强2Fe+3H2SO3═Fe2(SO4)3+3H2↑ |