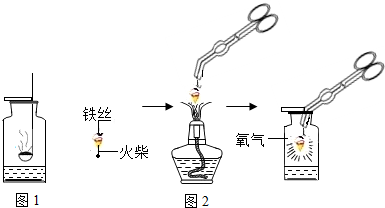
题目内容
 24、下列有两组实验,请根据实验中的问题写方程式.
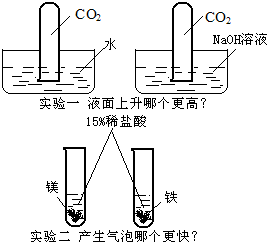
24、下列有两组实验,请根据实验中的问题写方程式.写出实验中“更高”的化学方程式:
2NaOH+CO2=Na2CO3+H2O
;写出反应“更快”的化学方程式:
Mg+2HCl═MgCl2+H2↑
.分析:根据第一组图示可知,二氧化碳与氢氧化钠反应导致压强减小,液面上升,但是二氧化碳与水反应生成的碳酸不稳定,很容易分解,再次生成气体,所以液面上升不是很大.而第二组中,根据金属活动性顺序表可知,金属排的越前,金属活动性越强,与酸反应越剧烈;然后根据化学方程式书写规则写出其化学方程式.
解答:解:根据分析可知,实验一中,二氧化碳与氢氧化钠溶液反应后导致液面上升的更高,它们反应生成了碳酸钠和水;
根据分析可知,镁排在铁的前面,活泼性强,与酸反应更剧烈,即镁与盐酸反应生成氯化镁和氢气
故正确答案:2NaOH+CO2=Na2CO3+H2O;Mg+2HCl═MgCl2+H2↑
根据分析可知,镁排在铁的前面,活泼性强,与酸反应更剧烈,即镁与盐酸反应生成氯化镁和氢气
故正确答案:2NaOH+CO2=Na2CO3+H2O;Mg+2HCl═MgCl2+H2↑
点评:本题以图示的实验情境,考查了学生应用所学二氧化碳、金属的性质对图示的分析能力和能够正确书写化学方程式.

练习册系列答案
相关题目