题目内容
【题目】煤是社会生产、生活中最重要的能源,工业上常把煤进行气化和液化处理,使煤变成清洁能源.煤气化和液化流程示意图如下: 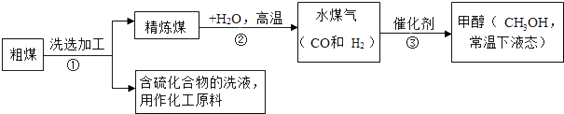
(1)第①步操作发生的是(选填“物理”或“化学”)变化.
(2)第②步是精炼煤与水蒸气的反应,化学方程式为 .
(3)第③步反应属于(填基本反应类型).
(4)含硫化合物洗液经过提炼后,可用来制硫酸,过程是:含硫化合物氧化得到SO2 , SO2进一步氧化得到X,X与水反应得到H2SO4 , 则X的化学式为 . .
(5)从“绿色化学”的角度分析,“煤的气化和煤的液化”生产流程的优点是 .
(6)甲醇(CH2OH)是基础化学原料,制备原理为CO+2H2 ![]() CH3OH.当消耗5.6kgCO时,计算生成甲醇的质量.写出计算过程.
CH3OH.当消耗5.6kgCO时,计算生成甲醇的质量.写出计算过程.
【答案】
(1)物理
(2)C+H2O(气)=CO+H2
(3)化合反应
(4)SO3
(5)原料全部被产品消纳(或原料全部转化为产品,或原子利用率100%等),实现“零排放”(或不对环境造成污染等)
(6)解:设生成的甲醇的质量为x
CO | + | 2H2 |
| CH3OH |
28 | 32 | |||
5.6kg | x |
![]()
解得:x=6.4kg
答:生成甲醇的质量是6.4kg.
【解析】解:(1)该过程没有新的物质生成,只是简单的分离,是物理变化.所以答案是:物理.(2)煤的主要成分是碳与水反应生成一氧化碳与氢气,再依据方程式的书写规律解决.所以答案是:C+H2O(气)=CO+H2(3)该过程中反应物是两种,生成物是一种,符合化合反应的特点.所以答案是:化合反应(4)二氧化硫再次氧化可生成三氧化硫,与水反应会生成硫酸.所以答案是:SO3 . (5)绿色化学主要主要是指反应时反应物全部会转化成生成物,同时实现无排放的过程.所以答案是:原料全部被产品消纳(或原料全部转化为产品,或原子利用率100%等),实现“零排放”(或不对环境造成污染等)
【考点精析】通过灵活运用质量守恒定律及其应用和书写化学方程式、文字表达式、电离方程式,掌握①质量守恒定律只适用于化学变化,不适用于物理变化;②不参加反应的物质质量及不是生成物的物质质量不能计入“总和”中;③要考虑空气中的物质是否参加反应或物质(如气体)有无遗漏;注意:a、配平 b、条件 c、箭号即可以解答此题.

 优等生题库系列答案
优等生题库系列答案