题目内容
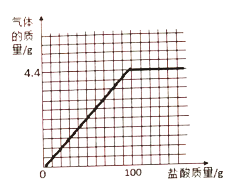
【题目】有一种不纯的K2CO3固体,可能含有Na2CO3、 MgCO3、 CuSO4、NaCl中的一种或几种。取该样品13.8g逐滴加入稀盐酸,产生气泡,最终得到无色溶液,产生气体随稀盐酸滴加的关系如图所示,下列判断正确的是
A.完全反应得到无色溶液,样品中可能含有CuSO4
B.NaCl 不与盐酸反应,样品中一定没有NaCl
C.所加稀盐酸中溶质的质量分数为7.3%
D.Na2CO3和MgCO3都能和盐酸反应生成气体,样品中一定有Na2CO3和MgCO3
【答案】C
【解析】
A、硫酸铜溶液为蓝色,恰好完全反应得到无色溶液,说明样品中一定没有硫酸铜,故A错误;
B、设生成4.4g二氧化碳需要碳酸钾的质量为x,盐酸中溶质的质量为y。
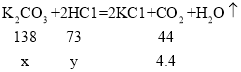
![]() x=13.8g
x=13.8g
![]() y=7.3g;
y=7.3g;
K2CO3固体样品不纯,根据近似平均值法,其中混有的杂质一种产生二氧化碳的能力比碳酸钾强,另一种产生二氧化碳的能力比碳酸钾弱,能产生二氧化碳的有碳酸钠(相对分子质量106)和碳酸镁(相对分子质量84),由于每分子碳酸钾、碳酸钠、碳酸镁中含有的碳酸根相同,可以通过比较相对分子质量来进行确定,碳酸钠和碳酸镁相对分子质量都比碳酸钾小,说明产生二氧化碳的能力比碳酸钾强,说明一定含有氯化钠,碳酸钠、碳酸镁至少有一种,故B错误;
C、根据B选项分析可知,所加稀盐酸中溶质的质量分数=![]() ,故C正确;
,故C正确;
D、根据选项B的分析,碳酸钠、碳酸镁至少有一种,故D错误。故选C。

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目