题目内容
27、水是重要的自然资源.
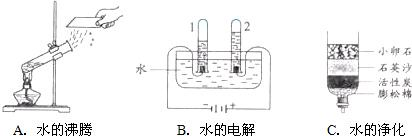
(1)下图所示的3个实验,A中水发生了
(2)将源水处理成自来水的过程中需加入生石灰,生石灰与水反应的化学方程式为
(3)实验室的废液需经处理才能排放,为减弱含有硫酸的废液的酸性,不能选用的物质是
A.废铁钉;B.熟石灰;C.二氧化碳;D.碳酸钠
(4)铁酸钠(Na2FeO4)是一种新型净水剂,具有絮凝和杀菌消毒作用.请将下列制取铁酸钠的化学方程式补充完整:2Fe(NO3)3+16NaOH+3Cl2=6NaNO3+6NaCl+2Na2FeO4+
(1)下图所示的3个实验,A中水发生了
物理
(填“物理”或“化学”)变化;B中试管1内得到的气体为氢气(或H2)
;C中净化水的方法是过滤
和吸附.
(2)将源水处理成自来水的过程中需加入生石灰,生石灰与水反应的化学方程式为
CaO+H2O=Ca(OH)2
.(3)实验室的废液需经处理才能排放,为减弱含有硫酸的废液的酸性,不能选用的物质是
C
(填字母序号).A.废铁钉;B.熟石灰;C.二氧化碳;D.碳酸钠
(4)铁酸钠(Na2FeO4)是一种新型净水剂,具有絮凝和杀菌消毒作用.请将下列制取铁酸钠的化学方程式补充完整:2Fe(NO3)3+16NaOH+3Cl2=6NaNO3+6NaCl+2Na2FeO4+
8H2O
.分析:本题以水为命题中心.综合考查了电解水的现象和结论、水的净化方法、酸的化学性质和化学方程式的书写,以及质量守恒定律,由于本题涉及的知识多,因此需要结合所学习的知识和技能和题目的具体情景,经仔细地分析后再作出应答.
解答:解:(1)图A是水的沸腾,水由液体变成气体,没有生成其他物质,因此该变化是物理变化;B图是电解水装置图,在电解水中,可看到的现象是:正极气体少,能使带火星的木条条复燃,是氧气,负极气体多,能燃烧,是氢气,体积多的是少的二倍,通过实验还能进一步推出水由氢元素和氧元素组成,试管1气体体积大,因此试管1中收集的气体是氢气;图C是自制净水器,其中卵石、石英砂、蓬松棉和滤纸功能一样,起到过滤作用,活性炭起着吸附作用;
(2)生石灰是氧化钙,能与水反应生成氢氧化钙,这是化学反应,用化学方程式表示为CaO+H2O=Ca(OH)2;
(3)为减弱含有硫酸的废液的酸性,必须消耗废液中氢离子,,
A、废铁钉,能与硫酸发生置换反应,产生氢气,故A不合题意,
B、熟石灰,熟石灰是氢氧化钙,能与硫酸发生中和反应,生成盐和水,故B不合题意,
C、二氧化碳,能与水反应生成碳酸,与硫酸不反应,不能消耗废液中的氢离子,故C符合题意,
D、碳酸钠,能与硫酸反应,生成硫酸钠、水和二氧化碳,能消耗废液中的氢离子,故D不合题意,
因此符合题意的选项是C;
(4)要写出生成物的化学式,主要是根据质量守恒定律,在化学反应前后原子的种类和数目都没有改变,可推出另一种物质化学式为H2O,化学计量数是8.
故答案是:(1)物理、氢气、过滤;
(2)CaO+H2O=Ca(OH)2;
(3)C;
(4)8H2O.
(2)生石灰是氧化钙,能与水反应生成氢氧化钙,这是化学反应,用化学方程式表示为CaO+H2O=Ca(OH)2;
(3)为减弱含有硫酸的废液的酸性,必须消耗废液中氢离子,,
A、废铁钉,能与硫酸发生置换反应,产生氢气,故A不合题意,
B、熟石灰,熟石灰是氢氧化钙,能与硫酸发生中和反应,生成盐和水,故B不合题意,
C、二氧化碳,能与水反应生成碳酸,与硫酸不反应,不能消耗废液中的氢离子,故C符合题意,
D、碳酸钠,能与硫酸反应,生成硫酸钠、水和二氧化碳,能消耗废液中的氢离子,故D不合题意,
因此符合题意的选项是C;
(4)要写出生成物的化学式,主要是根据质量守恒定律,在化学反应前后原子的种类和数目都没有改变,可推出另一种物质化学式为H2O,化学计量数是8.
故答案是:(1)物理、氢气、过滤;
(2)CaO+H2O=Ca(OH)2;
(3)C;
(4)8H2O.
点评:本题由于知识点和问题都比较多,因此要调用所学习的知识,根据具体情况进行具体而全面地分析后再作解答,不可随便盲目应答.

练习册系列答案
 全优点练单元计划系列答案
全优点练单元计划系列答案
相关题目


