题目内容
化肥硝酸铵的化学式为(NH4NO3).
试求:(1)硝酸铵中N、H、O三种元素的质量比;
(2)为了保证某一农作物获得3.5㎏氮元素,则需要硝酸铵多少㎏?
解:(1)根据硝酸铵的化学式可知,硝酸铵中N、H、O三种元素的质量比为:(14+14):(1×4):(16×3)=28:4:48=7:1:12;
(2)硝酸铵中氮元素的质量分数为: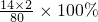 =35%,
=35%,
3.5kg÷35%=10kg.
答:(1)硝酸铵中N、H、O三种元素的质量比为7:1:12;
(2)为了保证某一农作物获得3.5㎏氮元素,则需要硝酸铵10kg.
分析:(1)根据硝酸铵的化学式可知,硝酸铵中N、H、O三种元素的质量比为:(N的相对原子质量×N原子个数):(H的相对原子质量×H原子个数):(O的相对原子质量×O原子个数);
(2)先计算出硝酸铵中氮元素的质量分数,然后根据氮元素的质量÷硝酸铵中氮元素的质量分数=硝酸铵的质量计算即可.
点评:本题主要考查学生运用化学式和元素的质量分数公式进行计算的能力.
(2)硝酸铵中氮元素的质量分数为:
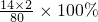 =35%,
=35%,3.5kg÷35%=10kg.
答:(1)硝酸铵中N、H、O三种元素的质量比为7:1:12;
(2)为了保证某一农作物获得3.5㎏氮元素,则需要硝酸铵10kg.
分析:(1)根据硝酸铵的化学式可知,硝酸铵中N、H、O三种元素的质量比为:(N的相对原子质量×N原子个数):(H的相对原子质量×H原子个数):(O的相对原子质量×O原子个数);
(2)先计算出硝酸铵中氮元素的质量分数,然后根据氮元素的质量÷硝酸铵中氮元素的质量分数=硝酸铵的质量计算即可.
点评:本题主要考查学生运用化学式和元素的质量分数公式进行计算的能力.

练习册系列答案
 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案 浙江之星课时优化作业系列答案
浙江之星课时优化作业系列答案
相关题目