题目内容
【题目】生活中常见物质的性质、制法的是化学研究的重要内容.
(1)复分解反应发生后,生成物肯定不会是(填“单质”或“化合物”).
(2)盐酸与氢氧化钠溶液反应时溶液pH的变化如图所示.下列说法正确的是 . 
a.m点所示溶液为碱性
b.n点所示溶液中加紫色石蕊溶液呈红色
c.p点所示溶液中的溶质为NaCl和NaOH
d.该图所对应操作是将盐酸滴入氢氧化钠溶液中
(3)浓硫酸和浓盐酸敞口放置均会变稀,这是为什么?
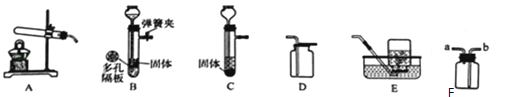
(4)如图装置可作一氧化碳还原氧化铁的实验,并检验生成的气体产物.
①B装置玻璃管里可观察到的现象为 .
②C装置中反应的化学方程式为 .
③实验结束后,若要确定A装置的溶液中溶质的成分,请设计合理的实验方案,简要写出实验步骤、现象和结论.(提示:Na2CO3溶液呈碱性)
(5)工业上可利用“铝热反应”焊接钢轨、冶炼难熔金属等,其原理是在高温下用铝将这些金属从其氧化物中置换出来,若用铝与四氧化三铁反应来制取25.2kg铁,理论上需要消耗铝的质量是多少?
【答案】
(1)单质
(2)c
(3)
浓硫酸具有吸水性,溶剂质量变大;浓盐酸具有挥发性,溶质质量减少.
(4)红色固体变黑;CO2+Ca(OH)2=CaCO3↓+H2O;二氧化碳和氢氧化钠反应会生成碳酸钠,碳酸钠、氢氧化钠都显碱性,检验氢氧化钠需要先检验并除去碳酸钠,实验方案是:向试管中加入过量的氯化钙溶液,若有白色沉淀生成,则溶质中含有碳酸钠;静置,取上层清液,滴加酚酞,若溶液变红,则溶质中含有氢氧化钠.
(5)
设需要消耗铝的质量为x
8Al+3Fe3O4![]() 9Fe+4Al2O3
9Fe+4Al2O3
216 504
x 25.2kg
![]()
x=10.8kg
答:需要消耗铝的质量为10.8kg.
【解析】(1)在复分解反应中,反应物和生成物都是两种化合物,没有单质生成;
(2)a、m点所示溶液的pH值小于7,所以溶液为酸性,故错误;
b、n点所示溶液的pH值等于7,所以溶液中加紫色石蕊溶液,颜色宝贝,故错误;
c、p点所示溶液的pH值大于7,所以溶液中的溶质为NaCl和NaOH,故正确;
d、该图中pH值是从小于7逐渐的增大到7,然后大于7,所以所对应操作是将氢氧化钠滴入盐酸中,故错误;
故选:c;
(3)浓硫酸具有吸水性,溶剂质量变大;浓盐酸具有挥发性,溶质质量减少;
(4)①氧化铁和一氧化碳在高温的条件下生成铁和二氧化碳,所以B装置玻璃管里可观察到的现象为:红色固体变黑;
②二氧化碳和氢氧化钙反应生成碳酸钙沉淀和水,化学方程式为:CO2+Ca(OH)2=CaCO3↓+H2O;
③二氧化碳和氢氧化钠反应会生成碳酸钠,碳酸钠、氢氧化钠都显碱性,检验氢氧化钠需要先检验并除去碳酸钠,实验方案是:向试管中加入过量的氯化钙溶液,若有白色沉淀生成,则溶质中含有碳酸钠;静置,取上层清液,低价酚酞,若溶液变红,则溶质中含有氢氧化钠;
所以答案是:(1)单质;(2)c;(3)浓硫酸具有吸水性,溶剂质量变大;浓盐酸具有挥发性,溶质质量减少;(4)①红色固体变黑;②CO2+Ca(OH)2=CaCO3↓+H2O;③向试管中加入过量的氯化钙溶液,若有白色沉淀生成,则溶质中含有碳酸钠;静置,取上层清液,滴加酚酞,若溶液变红,则溶质中含有氢氧化钠;(5)理论上需要消耗铝的质量是10.8kg.
【考点精析】关于本题考查的一氧化碳还原氧化铁和根据化学反应方程式的计算,需要了解原理:在高温下,利用焦炭与氧气反应生成的一氧化碳把铁从铁矿石里还原出来;各物质间质量比=系数×相对分子质量之比才能得出正确答案.

 名校课堂系列答案
名校课堂系列答案【题目】某品牌洁厕灵的成分是哦硫酸与盐酸的混合溶液,某课外活动小组想测定该品牌洁厕灵溶液中HCl的质量.取20g该品牌的洁厕灵溶液于烧杯中,不断滴加溶质质量分数为17.1%的氢氧化钡溶液,反应过程中烧杯中产生沉淀质量和烧杯中溶液pH值变化的部分数据如表所示:(已知BaCl2溶液的pH=7)
滴加氢氧化钡溶液的质量/g | 5 | 10 | 25 | 30 |
烧杯中产生沉淀的质量/g | 1.165 | 2.33 | 4.66 | 4.66 |
求:
(1)完全反应后生成沉淀的质量为;
(2)计算该洁厕灵溶液中HCl的质量分数为多少?(计算结果保留至0.1%)