题目内容
根据下列几种物质溶解度曲线图,得到的结论正确的是
| A.硝酸钾中混有少量氯化钠,采用蒸发结晶进行提纯 |
| B.氢氧化钙饱和溶液降低温度后有晶体析出 |
| C.80℃时,氯化钾与硫酸镁的溶解度相等 |
| D.所有物质的溶解度均随温度的升高而增大或随温度的降低而减小 |
C解析:
略
略

练习册系列答案
相关题目
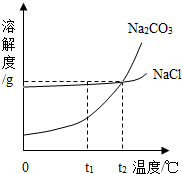 我国某地区有一种“冬天捞碱,夏天晒盐”的传统.这里的“碱”是指Na2CO3,“盐”是指NaCl.这样捞得的“碱”中会含有少量NaCl.下图为Na2CO3和NaCl的溶解度曲线和部分温度下的溶解度表(单位是克),看图回答下列问题:
我国某地区有一种“冬天捞碱,夏天晒盐”的传统.这里的“碱”是指Na2CO3,“盐”是指NaCl.这样捞得的“碱”中会含有少量NaCl.下图为Na2CO3和NaCl的溶解度曲线和部分温度下的溶解度表(单位是克),看图回答下列问题:(1)①t1℃时,NaCl的溶解度
②“冬天捞碱”的原因是由于Na2CO3的溶解度随温度降低而
③“夏天晒盐”是利用
A.利用风吹日晒,使溶剂蒸发 B.升高温度,使NaCl溶解度增大
(2)根据下表分析:
| 温度 物质 |
0℃ | 10℃ | 20℃ | 30℃ | 40℃ |
| NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 |
| Na2CO3 | 7.0 | 12.5 | 21.5 | 39.0 | 49.0 |
②下列几种说法中,正确的是
A.碳酸钠晶体的溶解度受温度影响较大
B.将含水各1OOg的氯化钠与碳酸钠的饱和溶液,从30℃降至O℃,析出晶体的质量相等 C.t2对应的温度在2O℃-30℃之间
D.欲从含有少量NaCl杂质的碳酸钠浓溶液中分离出碳酸钠晶体,应采取降低溶液温度的方式.
科学探究是奇妙的过程,请你一起参与下面两个实验的探究,并填写下列空白.
实验一:呼吸作用是否产生二氧化碳的探究.
[提出问题]呼吸作用是否产生二氧化碳?
[设计方案并进行实验]
小雪:在试管中加入2mL蒸馏水,用一支玻璃导管插入水中吹气,结果未发现明显的现象.
小宁:在试管中加入2mL澄清石灰水,用玻璃导管向试管中的溶液吹气,产生的现象是:澄清石灰水变浑浊,反应的化学方程式为:______.
[解释与结论]
根据他们的方案和实验,小雪方案中的实验原理用化学方程式表示为:______;小宁的结论为:______.
[评价与反思]
小宁认为小雪的方案若继续实验,也能得到同样的结论.请你帮他设计实验的方案:______.(要求写出实验操作及产生的现象).
实验二:融雪剂含有什么物质的探究.2008年春季,特大暴风雪袭击了我国南方地区,在抗击暴风雪的战斗中,融雪剂发挥了-定的作用.老师提供了一包某公司生产的融雪剂,已知它由碳酸钠、氯化镁、硫酸铜、氯化钠中的一种或几种物质组成.
[提出问题]该公司生产的融雪剂到底含有什么物质呢?
[查阅资料]含钠元素的物质在酒精灯的火焰上灼烧时会产生黄色火焰.
[实验探究]下面是小明设计的探究实验,请你帮他完成.
[反思和评价]
(1)写出③中反应的化学方程式_______.
(2)融雪剂融雪的原理是______.
(3)使用融雪剂有很多危害,例如会腐蚀道路、桥梁.请你再举一例______.
实验一:呼吸作用是否产生二氧化碳的探究.
[提出问题]呼吸作用是否产生二氧化碳?
[设计方案并进行实验]
小雪:在试管中加入2mL蒸馏水,用一支玻璃导管插入水中吹气,结果未发现明显的现象.
小宁:在试管中加入2mL澄清石灰水,用玻璃导管向试管中的溶液吹气,产生的现象是:澄清石灰水变浑浊,反应的化学方程式为:______.
[解释与结论]
根据他们的方案和实验,小雪方案中的实验原理用化学方程式表示为:______;小宁的结论为:______.
[评价与反思]
小宁认为小雪的方案若继续实验,也能得到同样的结论.请你帮他设计实验的方案:______.(要求写出实验操作及产生的现象).
实验二:融雪剂含有什么物质的探究.2008年春季,特大暴风雪袭击了我国南方地区,在抗击暴风雪的战斗中,融雪剂发挥了-定的作用.老师提供了一包某公司生产的融雪剂,已知它由碳酸钠、氯化镁、硫酸铜、氯化钠中的一种或几种物质组成.
[提出问题]该公司生产的融雪剂到底含有什么物质呢?
[查阅资料]含钠元素的物质在酒精灯的火焰上灼烧时会产生黄色火焰.
[实验探究]下面是小明设计的探究实验,请你帮他完成.
| 实验操作 | 实验现象 | 结论 |
| ①取少量融雪剂,加水溶解 | 得无色溶液 | 不含______物质 |
| ②另取少量融雪剂,滴加稀硫酸 | 无明显现象 | ______ |
| ③向该融雪剂的水溶液中滴加氢氧化钠溶液 | 出现白色沉淀 | ______ |
| ④______ | ______ | 含有氯化钠 |
(1)写出③中反应的化学方程式_______.
(2)融雪剂融雪的原理是______.
(3)使用融雪剂有很多危害,例如会腐蚀道路、桥梁.请你再举一例______.

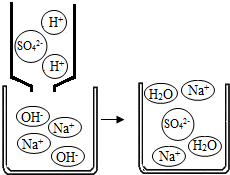 (2013?建邺区一模)氢氧化钠俗名苛性钠,是一种重要的化工原料.下列研究从其结构、制备方法、性质以及变化规律等角度进行,请根据要求回答相应问题.
(2013?建邺区一模)氢氧化钠俗名苛性钠,是一种重要的化工原料.下列研究从其结构、制备方法、性质以及变化规律等角度进行,请根据要求回答相应问题.