题目内容
5 g某金属M的样品(杂质不参与反应)与25g 20%的盐酸恰好完全反应,所生成的盐中,氯元素质量分数为50%,则样品中M的质量分数为
- A.50%
- B.95.5%
- C.97.3%
- D.99.1%
C
分析:根据质量守恒定律,化学反应前后元素的种类和质量不变,求出25g 20%的盐酸中氯元素的质量也就是求出生成的盐中氯元素的质量,进而求出生成的盐中M元素的质量,也就是金属M的质量,最后根据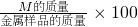 %求出样品中M的质量分数.
%求出样品中M的质量分数.
解答:盐酸中氯元素的质量= =4.863g;
=4.863g;
生成的盐中氯元素的质量分数为50%,则生成的盐中M元素的质量分数也为50%,生成的盐中氯元素的质量和M元素的质量相等,都为4.863g.
样品中M的质量分数=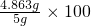 %=97.3%.
%=97.3%.
故选C.
点评:本题是一道特殊的有关化学方程式的计算题,解题关键是质量守恒定律的应用.
分析:根据质量守恒定律,化学反应前后元素的种类和质量不变,求出25g 20%的盐酸中氯元素的质量也就是求出生成的盐中氯元素的质量,进而求出生成的盐中M元素的质量,也就是金属M的质量,最后根据
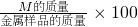 %求出样品中M的质量分数.
%求出样品中M的质量分数.解答:盐酸中氯元素的质量=
 =4.863g;
=4.863g;生成的盐中氯元素的质量分数为50%,则生成的盐中M元素的质量分数也为50%,生成的盐中氯元素的质量和M元素的质量相等,都为4.863g.
样品中M的质量分数=
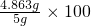 %=97.3%.
%=97.3%.故选C.
点评:本题是一道特殊的有关化学方程式的计算题,解题关键是质量守恒定律的应用.

练习册系列答案
 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案
相关题目
5 g某金属M的样品(杂质不参与反应)与25g 20%的盐酸恰好完全反应,所生成的盐中,氯元素质量分数为50%,则样品中M的质量分数为( )
| A、50% | B、95.5% | C、97.3% | D、99.1% |