题目内容
(2011?大兴区一模)在今年全国两会期间,代表们所使用的石头纸、环保手提袋和购物袋,主要原料是具有环保意义的碳酸钙.为测定某石头纸中碳酸钙的含量,某同学称取10g碎纸样品放入烧杯中,将50g 盐酸分5次加入烧杯.实验数据见下表(假设纸张其他成分既不溶于水,也不与盐酸反应):| 第1次 | 第2次 | 第3次 | 第4次 | 第5次 | |
| 加入稀盐酸的质量/g | 10 | 10 | 10 | 10 | 10 |
| 充分反应后烧杯及烧杯中物质总质量/g | 209.12 | 218.24 | 227.36 | 236.48 | 246.48 |
(2)计算样品中碳酸钙的质量分数.(写出计算过程)
【答案】分析:根据实验数据表,利用质量守恒定律,第2、3、4次加入10g稀盐酸均放出0.88g二氧化碳,而第5次加入10g稀盐酸不再放出气体,因此可判断前4次实验中,每次所产生的二氧化碳均为0.88g,反应放出二氧化碳的总质量即前四次反应得到二氧化碳的质量和,且样品中的碳酸钙完全反应;根据反应的化学方程式,由放出二氧化碳的质量计算样品中碳酸钙的质量,即可求得样品中碳酸钙的质量分数.
解答:解:(1)根据题意,利用质量守恒定律,可得前四次实验后碳酸钙恰好完全反应,且每次均放出二氧化碳0.88g;则10g样品与足量稀盐酸反应,最多生成二氧化碳的质量=0.88g×4=3.52g;
故答案为:3.52;
(2)设碳酸钙样品中碳酸钙的质量为x
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
x 3.52g
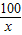 =
=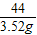
x=8g
样品中碳酸钙的质量分数=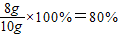
答:样品中碳酸钙的质量分数为80%.
点评:利用质量守恒定律,分析每次加入稀盐酸后烧杯及烧杯内物质总质量的变化,可以得出每次实验加入稀盐酸所放出二氧化碳的质量,据此对反应情况进行判断.
解答:解:(1)根据题意,利用质量守恒定律,可得前四次实验后碳酸钙恰好完全反应,且每次均放出二氧化碳0.88g;则10g样品与足量稀盐酸反应,最多生成二氧化碳的质量=0.88g×4=3.52g;
故答案为:3.52;
(2)设碳酸钙样品中碳酸钙的质量为x
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
x 3.52g
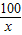 =
=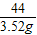
x=8g
样品中碳酸钙的质量分数=
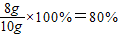
答:样品中碳酸钙的质量分数为80%.
点评:利用质量守恒定律,分析每次加入稀盐酸后烧杯及烧杯内物质总质量的变化,可以得出每次实验加入稀盐酸所放出二氧化碳的质量,据此对反应情况进行判断.

练习册系列答案
 中考利剑中考试卷汇编系列答案
中考利剑中考试卷汇编系列答案 教育世家状元卷系列答案
教育世家状元卷系列答案 黄冈课堂作业本系列答案
黄冈课堂作业本系列答案
相关题目
(2011?大兴区一模)下面是某兴趣小组同学做的3个小实验.根据实验内容回答下列问题.
| 序号 | 实验装置 | 实验操作 | 实验现象、解释或结论 |
(1) |  | ①关闭活塞K,给木炭加热. ②熄灭酒精灯,待木炭冷却后,打开活塞K,通入氧气. ③点燃酒精灯,给木炭加热. | ①木炭不燃烧. ②木炭不燃烧. ③木炭燃烧. 由此说明可燃物燃烧的条件是______. |
(2) |  | 打开分液漏斗的玻璃塞和活塞K,将稀硫酸注入小试管中. | 观察到的现象是______,由此说明二氧化碳的性质是______. |
(3) |  | 打开分液漏斗的玻璃塞和活塞K,将水注入人字形管中. | 观察到的现象是______,出现此现象的原因是______ ______. |
(2011?大兴区一模)下表列出了除去物质中所含少量杂质的方法,其中错误 的是( )
| 物质 | 所含杂质 | 除去杂质的方法 | |
| A | CO2 | CO | 点燃 |
| B | NaCl | 泥沙 | 溶解、过滤、蒸发 |
| C | Cu(NO3)2溶液 | AgNO3 | 加入过量的铜粉,过滤 |
| D | NaOH溶液 | Na2CO3 | 加入适量的氢氧化钙溶液,过滤 |

