��Ŀ����
����Ŀ��ʵ���ϳ������������ķ�ˮ���辭���������ԡ�ij��ȤС��ͬѧ����һ����������������������Һ���������Է�ˮ��
��1�����Լ���ˮ
����ˮ�����Եķ�����_____________��
��2������200 g��������Ϊ5.6%������������Һ
������
m (KOH)=_______g��V(H2O)=________mL��ˮ���ܶȽ���Ϊ1.0 g��mL-1����
����ȡ��������
����������ƽƽ���һֻ�ձ�����������ƽ�����̣�������������Ȼ��______���������Ⱥ�˳������ĸ����ֱ����ƽƽ�⡣
A�����ձ��м���������ͬ�� B������Ҫ�������롢�ƶ�����
����ȡˮ�����ܽ⣻��ת�ơ�
��3�������ⶨ��ˮ
ȡ���Է�ˮ��Ʒ100 g����μ���5.6%������������Һ����ˮ����������������仯������ͼ��ʾ���������ˮ�������ɷֲ����������ط�Ӧ�Ҳ�������أ�
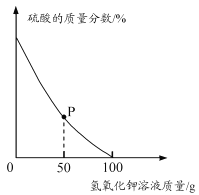
��P���Ӧ��Һ��һ�����ڵ���������_______�������ӷ��ţ���
�����Է�ˮ���������������Ϊ______���ðٷ�����ʾ��������0.1%����
�����㵱��ˮ����������ʱ����Һ������ص�����������д��������̣�����ðٷ�����ʾ��������0.l%����
���𰸡���1��ȡ����������ɫʯ����Һ�������������ԣ������������𰸣�
��2����11.2 188.8 ��BA
��3����K+��H+ ��4.9% ��4.4%
��������
��1��������Һ������Կ������ָʾ������ˮ�к������ᣬ��ô������ɫʯ����Һ�������ǣ�ȡ����������ɫʯ����Һ�������������ԣ�
��2��������200 g��������Ϊ5.6%������������Һ��
��Ҫ�������������ص�����=200g![]() 5.6%=11.2g��
5.6%=11.2g��
��Ҫ���ܼ�ˮ������=200g-11.2g=188.8g ��ˮ�����=![]() =188.8ml ��
=188.8ml ��
��Ҫ��ȡ11.2g���������أ�����������ƽƽ���Ҫ�Ȱ���Ҫ�������롢�ƶ����룬Ȼ�����ձ��м��������ع���ֱ����ƽƽ�⣻
��3�����������غ�ϡ���ᷴӦ��������غ�ˮ����ͼ��֪P��ʱ��Һ�л��������ᣬ��ô��Һ���е����������������أ������е��������������ӣ���ʾΪH+��������е��������Ǽ����ӣ���ʾΪK+��
����ͼ��֪���������غ�ϡ����ǡ����ȫ��Ӧʱ�����ĵ�����������Һ������Ϊ100g�����û�ѧ����ʽ�������������������ᷴӦ�������ȼ��ɼ����ϡ���������ʵ�������
100g����������Һ�����ʵ�����=![]() =5.6g
=5.6g
�����Է�ˮ�����������Ϊx�����ɵ�����ص�����Ϊy��
2KOH + H2SO4 == K2SO4 + 2H2O
112 98 174
5.6g x y
![]() x=4.9g
x=4.9g
���Է�ˮ���������������=![]() 4.9%��
4.9%��
��![]() y=8.7g
y=8.7g
��Ӧ����Һ������=100g+100g=200g
����������ʱ����Һ������ص���������=![]() 4.4%
4.4%
�����Է�ˮ���������������Ϊ4.9%������������ʱ����Һ������ص���������Ϊ4.4% ��

 ��˼ά������ҵϵ�д�
��˼ά������ҵϵ�д�����Ŀ�������ṩ��ʵ��װ�ûش����⡣
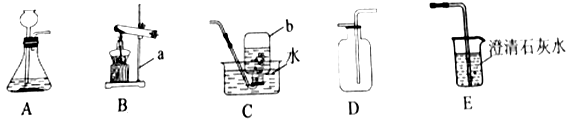
��1��д��ʵ�������ƣ�aΪ_______��bΪ__________��
��2��ʵ������Bװ����ȡO2��������Ӧ�Ļ�ѧ����ʽΪ__________��
��3��ʵ������ȡCO2�ķ������ռ�װ����________������ĸ��ţ���CO2ͨ��Eװ�ÿɹ۲쵽��ʵ��������____________��С����ʵ������Cװ���ռ���һƿCO2��Ϊ��Ū�����е��������ɲ�ȡ�Ŀ�ѧ̬�Ⱥͷ�����_______����������ţ���
����֮���� ���������� ���������� �������ʦ
��4��CO2����NaOH������Ӧ
��ʵ����̡����װ�������ԡ���ͼ��ʾ���Ӻ�װ�á�����ʵ�顣
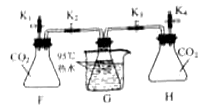
��� | �������� | ʵ������ |
I | ���ɼ�K1���رյ��ɼ�K2��K3��K4����20mLˮע����ƿF�У��رյ��ɼ�K1����ƿF�����ɼ�K2 | ���������� |
II | �رյ��ɼ�K2�����ɼ�K4����20mLNaOH��Һע����ƿH�У��رյ��ɼ�K4����ƿH�����ɼ�K3 | ��ƿG�е���ˮ���ҷ��� |
��ʵ���������ƿG����ˮ���ҷ��ڵ�ԭ����_____________��
��ʵ�鷴˼���й۵���Ϊֻ��Ҫ����ʵ�������������˵��CO2��NaOH������Ӧ����Ըù۵�Ŀ�����________��ѡ������ͬ����������ͬ������������____________��