题目内容
(2008?无锡)某石灰厂有一批石灰石原料,为了测定该石灰石的纯度,厂化验室技术员称取6.25g研碎的石灰石粉末,进行四次高温煅烧(杂质没有变化)、冷却、称量剩余固体质量的重复操作,记录数据如下:(提示:碳酸钙在高温下分解,生成氧化钙和二氧化碳气体)| 操作次序 | 第一次 | 第二次 | 第三次 | 第四次 |
| 剩余固体质量 | 5.55g | 4.35g | 4.05g | 4.05g |
(2)石灰石样品中碳酸钙的质量分数.
【答案】分析:(1)由图表可知,第三次与第四次反应后剩余固体质量相等,说明,第三次已是完全反应.根据质量守恒定律,在化学反应中,参加反应前各物质的质量总和等于反应后生成各物质的质量总和.完全反应后生成二氧化碳的质量=反应前各物质的质量总和-反应后生成各物质的质量总和;
(2)根据碳酸钙高温煅烧的化学方程式和生成的二氧化碳的质量,就可计算出需碳酸钙的质量,然后根据质量分数公式计算即可.
解答:解:(1)完全反应后生成二氧化碳的质量为:6.25g-4.05g=2.2g;故答案为:2.2g;
(2)解:设生成2.2g二氧化碳,需碳酸钙的质量为x.
CaCO3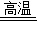 CaO+CO2↑
CaO+CO2↑
100----------44
X------------2.2g.
∴
解得:X=5g,
石灰石样品中碳酸钙的质量分数: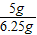 ×100%=80%.
×100%=80%.
答:石灰石样品中碳酸钙的质量分数为80%.
点评:本题主要考查学生运用化学方程式和质量分数公式进行计算的能力.
(2)根据碳酸钙高温煅烧的化学方程式和生成的二氧化碳的质量,就可计算出需碳酸钙的质量,然后根据质量分数公式计算即可.
解答:解:(1)完全反应后生成二氧化碳的质量为:6.25g-4.05g=2.2g;故答案为:2.2g;
(2)解:设生成2.2g二氧化碳,需碳酸钙的质量为x.
CaCO3
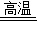 CaO+CO2↑
CaO+CO2↑100----------44
X------------2.2g.
∴

解得:X=5g,
石灰石样品中碳酸钙的质量分数:
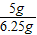 ×100%=80%.
×100%=80%.答:石灰石样品中碳酸钙的质量分数为80%.
点评:本题主要考查学生运用化学方程式和质量分数公式进行计算的能力.

练习册系列答案
相关题目
 (2008?无锡一模)某化学实验小组在进行有关CO2的实验时用到了下列装置.
(2008?无锡一模)某化学实验小组在进行有关CO2的实验时用到了下列装置. (2008?无锡一模)某化学实验小组在进行有关CO2的实验时用到了下列装置.
(2008?无锡一模)某化学实验小组在进行有关CO2的实验时用到了下列装置.