题目内容
【题目】某化学兴趣小组同学用实验室存放近一年的溶质质量分数为30%H202溶液(如下图一),进行如下实验:
(1)小亮从瓶中取出50mL溶液,稀释成10%的H202溶液待用,理论上他需要加水 __ mL。
(2)小丽同学用上述稀释后的H202溶液和下图二装置探究不同物质对H202的催化效果是否相同。实验中她看到左侧试管比右侧试管中产生气泡的速率快,此外还观察到____,说明Mn02对此反应的催化效果比水泥好。请判断该实验设计是否合理并说明理由:____。
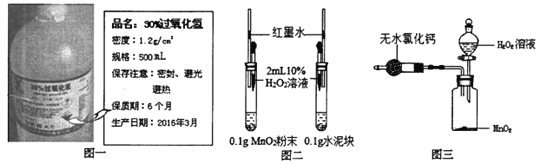
(3)小杰同学用上图三装置测定上述稀释后的H202溶液的溶质质量分数是否为10%,反应前他在分液漏斗中加入50 g稀释后的H202溶液,在干燥管中加入足量无水氯化钙,并在广口瓶中加入适量Mn02样品,共称得装置和药品的总质量力564.57g。打开分液漏斗活塞,使H202溶液全部流入瓶中,迅速关紧活塞,待反应结束后,称得装置及其内所有物质的总质量为562.97g。
①请计算上述稀释后的H202溶液的溶质质量分数与10%是否相符?____(请写出具体计算过程)
②若不符合,其可能的原因是____ 。(注:若符合,此问不作答)
【答案】 120 左边试管内玻璃管中的红墨水水柱向上移动得快 不合理,因为所用二氧化锰和水泥块的形状(或颗粒大小)不同 不符合 有少量生成的氧气滞留在广口瓶中(或原来30%的过氧化氢溶液中有部分 H2O2 已经分解,造成浓度降低或其他合理答案)
【解析】(1)设加入水的质量为x(溶液密度为1.2g/cm3也就是1.2g/mL)
由于稀释过程中溶质的质量不变,
50mL×1.2g/mL×30%=(50mL×1.2g/mL+x)×10%
x=120g折合体积为120mL.
(2)小丽同学用上述稀释后的H2O2溶液和图二装置探究不同物质对H2O2的催化效果是否相同。设计意图是借助生成氧气的速度判断催化剂的效果,所以她关注气泡的生成速度或者是单位时间内红色墨水的上移的速度。实验中她看到左侧试管比右侧试管中产生气泡的速率快,此外还观察到 左边试管内玻璃管中的红墨水水柱向上移动得快,说明MnO2对此反应的催化效果比水泥好。由于对比实验中要控制除探究要素之外的要素保持一致,本实验是探究不同物质的催化效果,所以除了物质品种不同以外,物质的颗粒大小或者形状等应该几乎完全相同,而不能有明显的差异。现在题目所用物质一个是粉末一个是块状的,所以该实验设计不合理。
(3)根据质量守恒定律可得,氧气的质量=564.57g-562.97g=1.6g
设50g过氧化氢溶液中含有H2O2的质量为x
2H2O2 ![]() 2H2O+O2↑
2H2O+O2↑
68 32
x 1.6g
![]()
x=3.4g
所用过氧化氢溶液中过氧化氢的质量分数为![]() ×100%=6.8%<10%
×100%=6.8%<10%
与稀释后的溶液浓度不符合
不符合原因一方面是现有实验本身有关,如有少量生成的氧气滞留在广口瓶中,另外还可能是过氧化氢久置所致导致部分的过氧化氢分解。

 步步高达标卷系列答案
步步高达标卷系列答案【题目】在实验室中甲乙两位同学分别进行了如下实验,其中甲观察到固体全部消失有气泡冒出,甲同学实验中发生的反应类型是______,乙同学实验中观察到的现象是______。反应结束后甲乙两位同学将仪器中药品全部倒在一个大烧杯中后观察到有气泡冒出和大量白色沉淀生成。

【问题】:反应后大烧杯中上层清液中中含有哪些溶质?
【猜想】:①可能只含有:NaCl ②可能含有CaCl2、NaCl ③可能含有CaCl2、NaCl 和 Na2CO3 ④ 可能含有、NaCl 、Na2CO3 。
甲乙两位同学通过讨论一致认为上述猜想_____ 一定不成立,理由是_________。
【实验】:
实验步骤 | 实验现象 | 实验结论 |
1、取少量上层清液于一支试管中,滴加足量K2CO3溶液 | ___________ | 猜想②不成立 |
2、取少量上层清液于一支试管中,滴加足量Ba(NO3)2溶液 | 白色沉淀 | 猜想________ 成立 |
3、取少量上层清液于一支试管中,滴加1-2滴酚酞 | ___________ |